これからはじめる ミトコンドリア研究
- ミトコンドリアとは?
- 関連セミナー/学術動画
- ミトコンドリア関連 研究用試薬の比較
ミトコンドリアマップ , マイトファジー / 酸化ストレス関連 , 膜電位 / 局在確認 , 金属イオン検出 , その他の関連試薬
- ミトコンドリア膜電位と疾患の関係性
なぜミトコンドリア膜電位が見られているか
- 関連の学術情報
ミトコンドリアとは?
ミトコンドリアは我々ヒトを始めとするほとんどの真核生物の細胞内に存在する細胞小器官の1つです。数ある細胞小器官のなかでも特にエネルギー産生(アデノシン三リン酸:ATP)において重要な役割を果たすミトコンドリアは、その形態、機能、活性など様々な指標について盛んに研究が行われています。また、ミトコンドリアの活性や機能障害が癌や老化、アルツハイマーやパーキンソン病等の神経変性疾患などと密接に関与していることが明らかになってきています。本ページではミトコンドリアの状態を理解するうえで重要な指標である「ミトコンドリア膜電位」を始めとする様々な指標に対する研究用試薬をご紹介しています。
- ミトコンドリア膜電位と各種疾患との関係についての学術情報 (ページリンク)
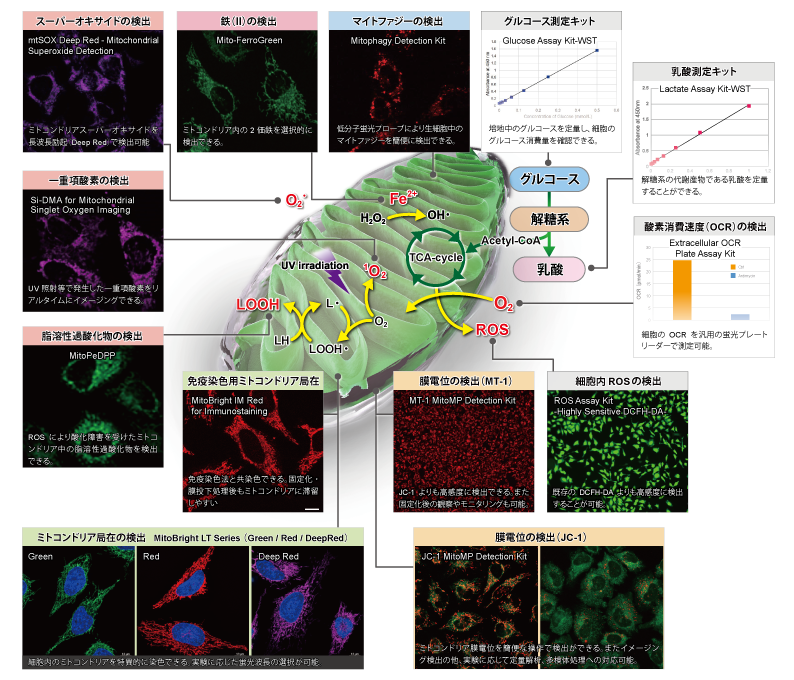
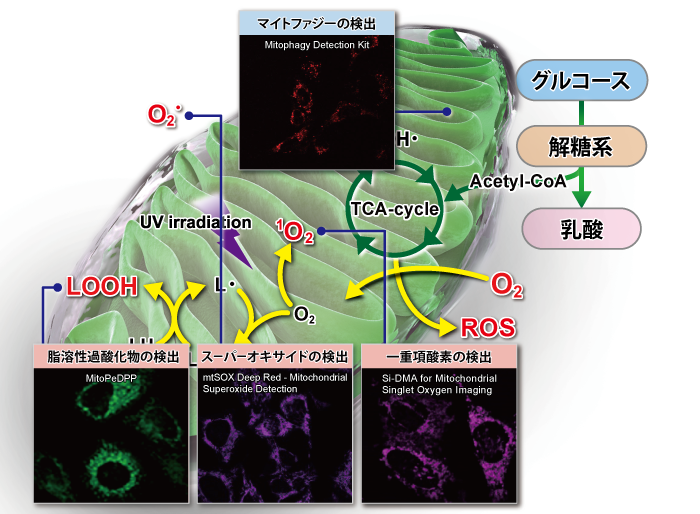
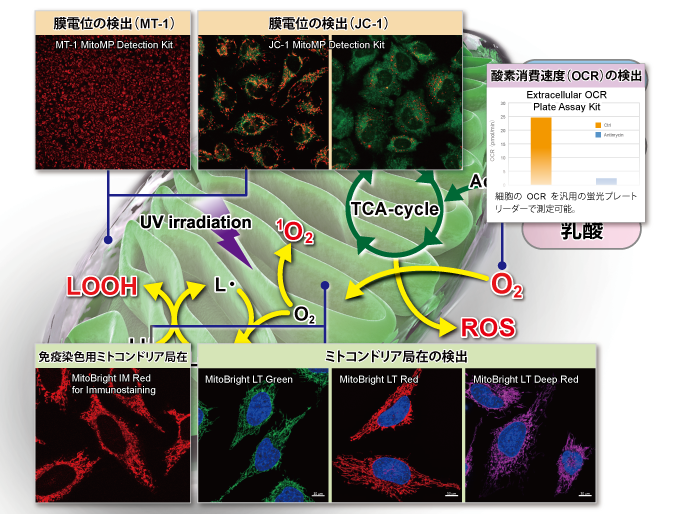
下記表では、ミトコンドリア研究用試薬として、損傷ミトコンドリアの品質管理システムであるマイトファジー検出(Mitophagy Detection Kit, Keima-Red)をはじめ、ROS:活性酸素種の検出(Si-DMA、mtSOX、MitoSOX)およびROSにより酸化を受け生じた過酸化脂質などの脂溶性過酸化物の検出(MitoPeDPP)、更にはミトコンドリア染色用および膜電位依存的な各種蛍光プローブ(MitoBright LTシリーズ [Green] [Red] [Deep Red])、MitoBright IM、MitoTrackerシリーズ、JC-1、MT-1)の特徴を紹介しています。
セミナー/学術動画
ミトコンドリア:試薬の選び方 |
細胞内代謝測定:試薬の選び方 |
細胞内代謝測定:試薬の使い方 |
グルコース取込み検出:開発者解説 |
細胞増殖/毒性試験:試薬の選び方 |
|
ミトコンドリア解析法と関連する セミナー本編はこちら |
各代謝測定法の比較や測定意義を セミナー本編はこちら |
細胞内代謝と関連の複数指標を、効率よく一サンプルで測定する方法を紹介 セミナー本編はこちら |
検出目的から従来測定法との比較など 開発者の解説動画はこちら |
各種測定法の原理と指標を解説し |
ミトコンドリア関連 研究用試薬の比較
各カテゴリ詳細を選択してください。
| 出対象 | 試薬名 | 検出原理 | ミトコンドリア集積性 | 生細胞の染色・観察 (染色後の固定) |
固定細胞への染色・観察 | 励起/蛍光 (nm) | 染色時間*1 | 同仁製品コード | ||
|---|---|---|---|---|---|---|---|---|---|---|
| マイトファジー | Mitophagy Detection Kit*3 | マイトファジーによる ミトコンドリア内のpH低下に応答して蛍光が増大 |
〇 (共有結合) |
〇 (×) |
× | 530/700 | 30分~ | MD01 | ||
| Keima-Red | マイトファジーによる ミトコンドリア内のpH低下に応答して蛍光特性が変化 |
- (発現タンパク質) |
〇 (×) |
× | 550 & 440/620 | *2 | - | |||
| 脂溶性過酸化物 | MitoPeDPP | 脂溶性過酸化物に特異的に応答して 蛍光が増大 |
〇 (静電的相互作用) |
〇 (×) |
× | 452/470 | 15分~ | M466 | ||
| 一重項酸素 | Si-DMA | 一重項酸素に特異的に応答して 蛍光が増大 |
〇 (静電的相互作用) |
〇 (×) |
× | 644/670 | 45分~ | MT05 | ||
| スーパーオキサイド | MitoBright ROS | スーパーオキサイドに特異的に応答して 蛍光が増大 |
〇 (静電的相互作用) |
〇 (×) |
× | 540/670 | 30分~ | MT16 | ||
| MitoSOX | スーパーオキサイドに特異的に応答して 蛍光が増大 |
〇 (静電的相互作用) |
〇 (×) |
× | 510/580 | 10分~ | - | |||
*1 試料の種類や試薬濃度に応じて変わる
*2 細胞に遺伝子導入しKeima発現株を構築
*3 キットコンポーネントMtphagy Dye[コード:MT02]を単品を販売しています。
| 検出対象 | 試薬名 | 検出原理 | 生細胞の染色・観察 (染色後のPFA固定) |
染色後のMeOH固定 | 固定細胞への染色・観察 | 細胞内長期滞留性 | 血清入り培地中での染色 | 励起/蛍光 (nm) | 染色時間*1 | 同仁製品コード |
|---|---|---|---|---|---|---|---|---|---|---|
| ミトコンドリアの 膜電位差 |
MT-1 | JC-1よりも高感度な検出が可能で 固定化後の観察とモニタリングができる |
〇 (〇) |
× | × | - | - | 530-560/570-640 | 30 分 | MT13 |
| JC-1 | ミトコンドリアの膜電位に応答して 蛍光特性が変化 |
〇 (×) |
× | × | - | - | 高い膜電位: 514/529 低い膜電位: 585/590 |
10~60 分 | MT09 | |
| ミトコンドリアの 局在 |
MitoBright LT series | 静電的相互作用で集積 | 〇 (〇) |
× | × | 〇 | 〇 | Green:493/508 Red:547/563 Deep Red:643/663 |
10 分~ | MT10 MT11 MT12 |
| MitoBright IM | 静電的相互作用で集積 その後ミトコンドリアに固定されるため膜透過処理も可能 |
〇 (〇) |
〇 | × | × | × | 561/560-620 | 30分~ | MT15 | |
| MitoTracker series | 静電的相互作用で集積 | 〇 (〇) |
× | × | × | △ | 490/516 ~ 644/665 |
15~45 分 | - | |
| Rhodamine 123 | 静電的相互作用で集積 | 〇 (×) |
× | × | × | × | 507/529 | 15 分~ | - | |
| 細胞の 酸素消費速度 (OCR*2) |
Extracellular OCR Plate Assay Kit |
細胞のOCRを汎用の蛍光プレートリーダーで測定できる。 (培養液中の酸素濃度の減少量を測定し細胞のOCRを算出) |
- | - | - | - | - | 500/650 | 200分 (測定時間) |
E297 |
*1 試料の種類や試薬濃度に応じて変わる
*2 OCR:Oxygen Consumption Rate
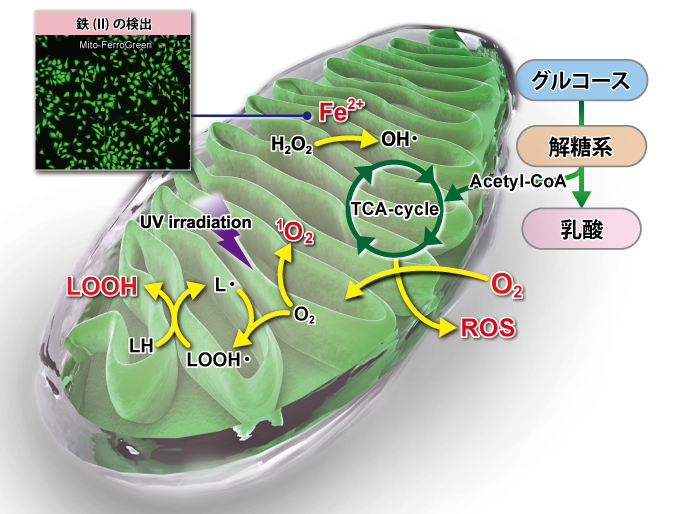
| 検出対象 | 試薬名 | 検出原理 | ミトコンドリア集積性 | 生細胞の染色・観察 (染色後のPFA固定) |
固定細胞への 染色・観察 |
励起/蛍光 (nm) | 染色時間*1 | 同仁製品コード |
|---|---|---|---|---|---|---|---|---|
| ミトコンドリアのCa | Rhod 2-AM | ミトコンドリアに集積後細胞内Ca2+と結合し 蛍光強度が増大 |
〇 (静電相互作用) |
〇 (×) |
× | 553/576 | 30~60分 | R002 |
| ミトコンドリアの鉄 | Mito-Ferro Green | 鉄(II)イオンと選択的に反応し強い蛍光を発する | 〇 (静電相互作用) |
〇 (×) |
× | 505/535 | 30~ | M489 |
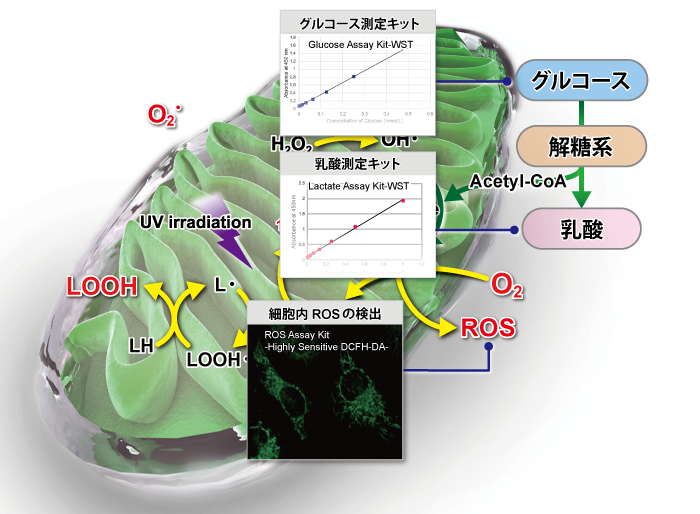
| 検出対象 | 試薬名 | 検出原理 | 同仁製品コード |
|---|---|---|---|
| グルコース測定キット | Glucose Assay Kit-WST | グルコース量に応じ発色したWSTホルマザンを吸光度測定することで、 細胞培養液や細胞内のグルコースを検出 |
G264 |
| 乳酸測定キット | Lactate Assay Kit-WST | 乳酸量に応じ発色したWSTホルマザンを吸光度測定することで、 細胞培養液や細胞内の乳酸を検出 |
L256 |
| 細胞内ROS検出キット | ROS Assay Kit | 細胞内で発生した活性酸素種(ROS)と反応して強い蛍光を発する | R252 |
| 耐光性トータルROS検出キット | ROS Assay Kit -Photo-oxidation Resistant DCFH-DA- |
色素の耐光性高く、ROS 発生の継時変化が観察可能 |
R253 |
ミトコンドリア膜電位と疾患の関係性
ミトコンドリア膜電位はミトコンドリアの状態を理解するための重要な指標です。本項では関連のある疾患や各指標について学術情報をまとめました。
下記のタイトルをクリックで該当項目にジャンプします
なぜミトコンドリア膜電位が見られているか
ミトコンドリア膜電位と老化との関連性
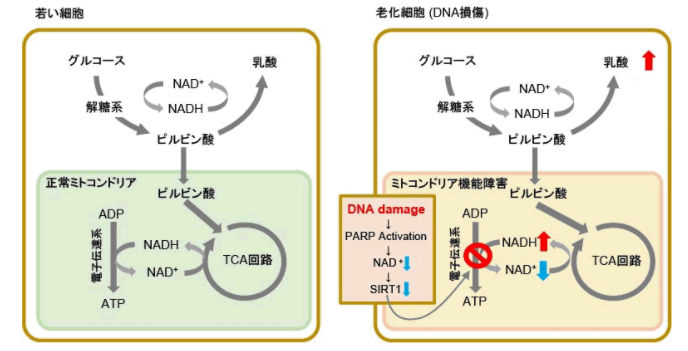
老化細胞ではミトコンドリア機能低下に伴い、嫌気的解糖系によるATP産生を主とするため、乳酸産生量が増加しています1)。
老化によるミトコンドリア機能低下の要因の一つとして、DNA損傷が挙げられます。DNAへのダメージが蓄積するとDNA修復機構が活性化し、NAD+消費量が増加します。
NAD+量の減少はミトコンドリア機能維持に重要な因子であるSIRT1活性を下げ、ミトコンドリア機能低下(電子伝達系阻害→ATP産生・NAD+量の低下)を招きます2), 3)。
<参考文献>
1) Z. Feng, R. W. Hanson, N. A. Berger and A. Trubitsyn, “Reprogramming of energy metabolism as a driver of aging”, Oncotarget., 2016, 7(13), 15410.
2) J. Wu, Z. Jin, H. Zheng and L. Yan, “Sources and implications of NADH/NAD+ redox imbalance in diabetes and its complications”, Diabetes Metab. Syndr. Obes., 2016, 9, 145.
3) S. Imai and L. Guarente, “NAD+ and sirtuins in aging and disease”, Trends in Cell Biology, 2014, 24(8), 464.
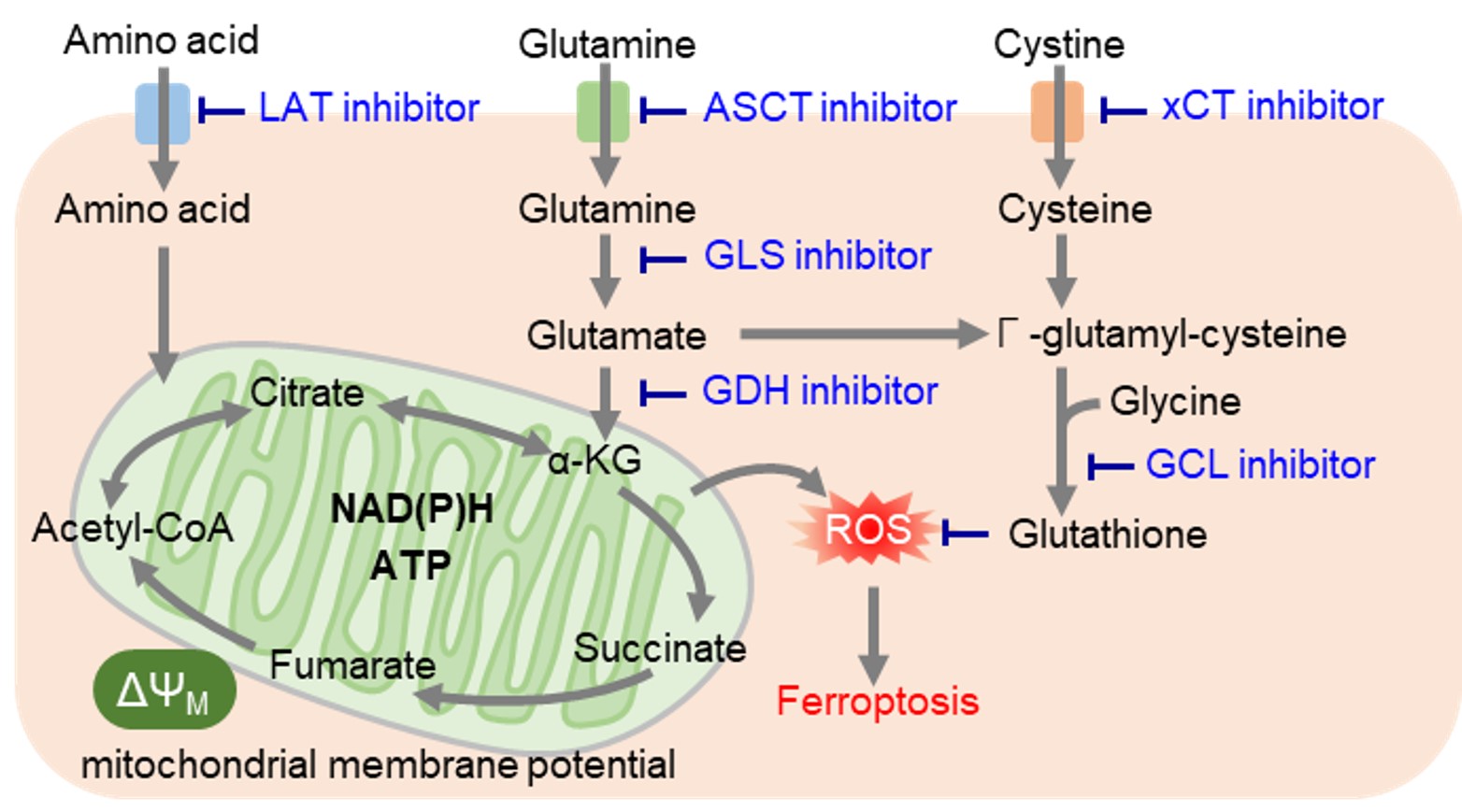
ミトコンドリア膜電位と抗ガン作用
|
がん細胞では解糖系からのアセチルCoAの供給が低下するため、TCAサイクルの栄養源としてアミノ酸を積極的に利用しています。そのため、がん細胞ではアミノ酸トランスポーターの発現量を増やして、多くのアミノ酸を取り込んでいることが明らかとなっています。特にグルタミンは、グルタチオンの原料、およびTCAサイクルに必須なα-ケトグルタル酸の供給源であり、グルタミンの取り込みや代謝(グルタミノリシス)をターゲットとした薬剤開発が注目されています。また、多くの必須アミノ酸の取り込みに関与するアミノ酸トランスポーターLAT(L-type amino acid transporter)が多くのがん細胞で過剰発現していることがわかり、新しい創薬ターゲットとして期待されています。 レドックス制御に必要なシステインは、他のアミノ酸とは異なり、主にシスチントランスポーターであるxCTによって細胞内に取り込まれています。がん細胞では活性酸素が大量に発生しているため、抗酸化物質であるグルタチオン産生を高めてレドックスバランスを維持しています。そのため、グルタチオン産生に関与する経路を阻害することで細胞内レドックスバランスを変化させ、フェロトーシスなどの細胞死を誘導することが可能です。またグルタチオンは薬剤耐性にも寄与しているため、グルタチオン産生に関与する経路は薬剤開発の主要なターゲットとなっています。特に最近では抗炎症薬として古くから用いられているスルファサラジンやがんの分子標的治療薬であるソラフェニブがxCTを阻害することが明らかとなり、 xCT阻害によるフェロトーシスを介した抗がん作用に注目が集まっています。 |
<参考文献>
| 細胞 | 薬剤・刺激 | 細胞内代謝の状態 | 文献 |
|---|---|---|---|
|
T細胞リンパ腫(KO99L) |
LAT1阻害剤:JPH203 |
ミトコンドリア膜電位 ↓、オートファジー ↑ |
Leukemia, 2015, 29, 1253 |
ミトコンドリア膜電位とNASH(非アルコール性脂肪肝炎)
非アルコール性肝疾患(NAFLD)は飲酒歴にかかわらず、高齢者に好発する肝臓の病態変化であり、脂肪肝(Steatosis)から非アルコール性脂肪肝炎(NASH)を経て、線維化を伴う肝硬変(Cirrhosis)・肝癌(HCC)へと進行する包括的な疾患概念です1)。近年、細胞老化とそれに伴うミトコンドリア機能異常がNAFLD/NASHの進展に大きく寄与していることが報告され注目を集めております2,3,4,5)。NAFLD/NASHのリスクファクターである肥満状態では、脂質の沈着が増加し活性酸素種(ROS)や炎症性サイトカインの産生が亢進し、細胞老化が惹起されます2)。細胞老化に伴うNAD+量の低下によりミトコンドリア機能は低下3)し、ミトコンドリア機能の低下はさらなるNAD+量の低下を招き老化様の細胞機能変化を増長します4)。一方で肝臓特異的に細胞老化を誘導することで脂質沈着の増加、線維化の促進が認められたこと5)から、NAFLD/NASHの進展過程では細胞老化やミトコンドリア機能異常、それに付随する代謝変化が複雑に平衡して炎症・線維性の病態を形成していることが明らかとなっております。今後この複雑な平衡関係とNAFLD/NASHとの関係をより詳細に解析していくことが新たな治療方法確立への一助となると期待されています。
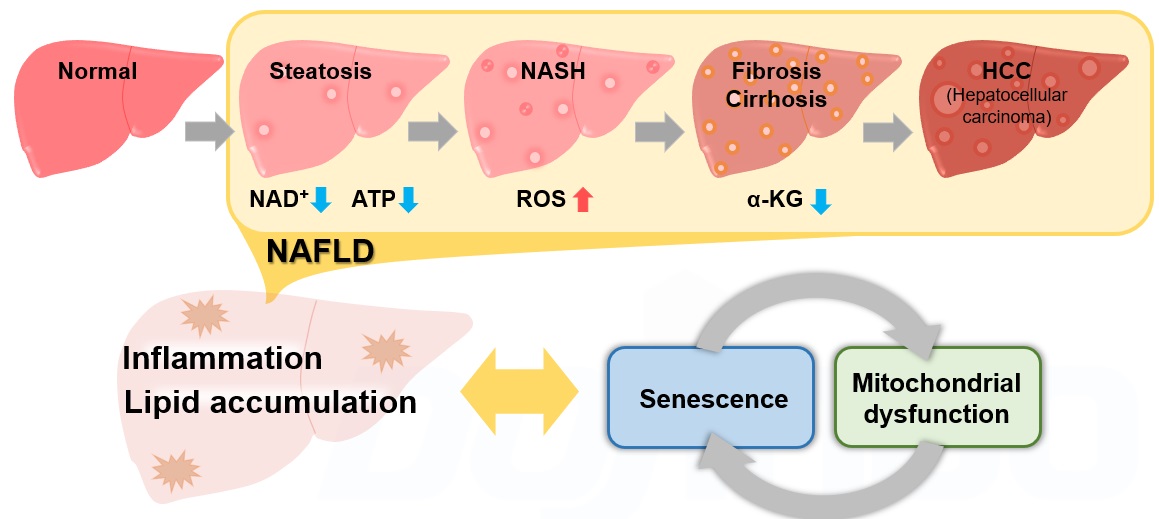
各NAFLD/NASHモデルにおける報告例 ※表中の指標にあるリンクをクリックすると測定キット・試薬ページが開きます。
| NAFLD/NASHモデル | 細胞機能、代謝変化等 | 文献 |
|---|---|---|
| 老化、肥満、糖尿病モデルマウス | 肝細胞老化(SA-β-Gal↑、p21↑)⇒ 老化細胞の除去により病態改善 | Nat. Commun., 2016, 8, 15691. |
| 高脂肪食+高コレステロール食処理マウス | 肝臓でのミトコンドリア機能異常(ATP↓、膜電位↓、過酸化水素産生量↑) | Redox Biol., 2018, 15, 86-96 |
| 高脂肪食処理マウス | 肝臓でのミトコンドリア機能異常(ATP↓、NAD↓)、PARP↑ ⇒ PARP発現抑制によりミトコンドリア機能改善及び病態改善 | J. Hepatol., 2017, 66, 132–141 |
| 肝星細胞線維化モデル | α-ketoglutarate↑、type I collagen↑ → α-ketoglutarateの添加で線維化改善 | Biosci. Rep., 2020, 40, BSR20193385 |
| 高脂肪食処理マウス | 肝臓での脂質沈着↑、肝機能↓ → α-ketoglutarateの添加で病態改善 | Liver Res., 2020, 4, 94e10095 |
関連の学術情報