|
固形がんの治療においてCD8+ T細胞の浸潤は極めて重要であるが、CD8+ T細胞の立体運動に関する代謝要件は不明なままである。本論文では、CD8+ T細胞の遊走は、脂肪酸ではなくグルコースとグルタミンのミトコンドリアでの酸化に依存しており、ミトコンドリアが産生するATPと活性酸素の両方がT細胞の遊走に必要であることを明らかにし、固形がん治療におけるCAR T細胞の遊走と抗腫瘍効果を増強するために、ミトコンドリア代謝を標的とすることの重要性を示唆している。
|
|
Mitochondrial metabolism sustains CD8+ T cell migration for an efficient infiltration into solid tumors
論文へのアクセスはこちら: Simula, L., et. al., Nature Communications, 2024.
|
|
注目ポイント
・CD8+ T細胞の間質性運動には、脂肪酸ではなくグルコースとグルタミンのミトコンドリアでの酸化が必要である
・T細胞が移動するためには、ミトコンドリアが産生するATPと活性酸素の両方が必要である
・ミトコンドリア活性を高めると、CD8+ T細胞の腫瘍内遊走とCAR T細胞の腫瘍膵島への動員が改善される
|
| 関連製品 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| アプリケーションデータ |
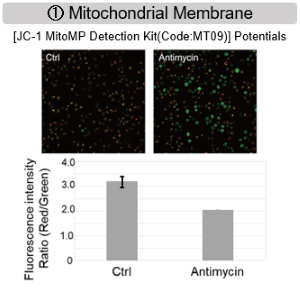
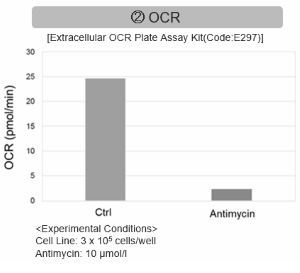
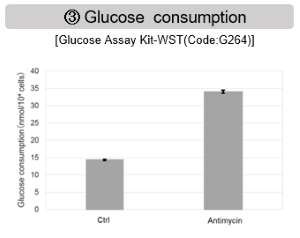
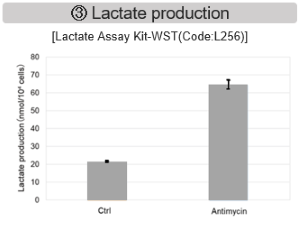
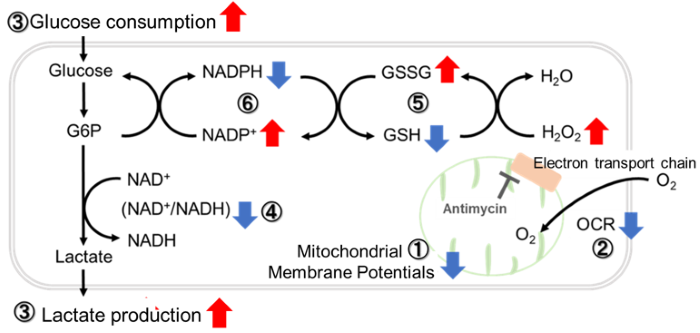
ミトコンドリア電子伝達系の阻害
-
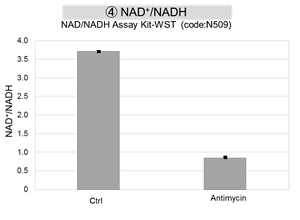
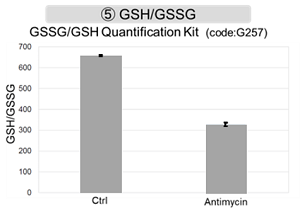
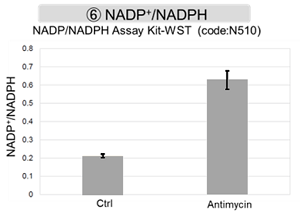
Jurkat細胞にAntimycin刺激を行い、ミトコンドリア電子伝達系を阻害した際の細胞の状態変化を、様々な指標から評価した。
その結果、電子伝達系の阻害により①ミトコンドリア膜電位の低下および②OCRが低下した。また、③解糖系を強制的に維持するために、ピルビン酸から乳酸への代謝が亢進することで、④解糖系全体のNAD+/NADH比が低下し、さらに活性酸素種(ROS)増加に伴う⑤GSH枯渇、グルタチオン生合成に必要なNADPHの減少に伴う⑥NADP+/NADPH比の増加を確認した。
|
2種類のがん細胞における代謝経路の比較
<Lactate生成量とATP量による評価>
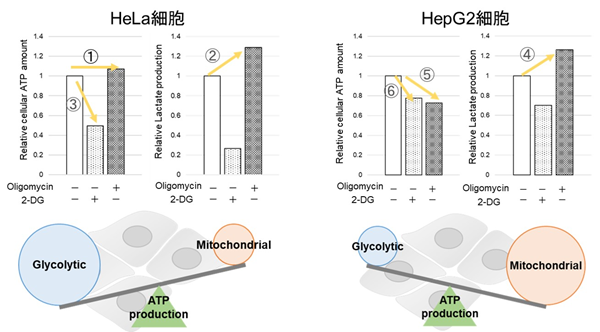
-
Oligomycin刺激により酸化的リン酸化でのATP合成を阻害、また2-Deoxy-D-glucose(2-DG)により解糖系でのATP合成を阻害した際のATP量とLactate生成量の変化を確認したところ、HeLa細胞は解糖系に依存し、HepG2細胞は酸化的リン酸化に依存してATP合成している結果が得られた。
HeLa細胞は酸化的リン酸化を阻害した際、ATP量は変わらず(①)、Lactate生成量が増加する(②)ことから、酸化的リン酸化が阻害されても解糖系をさらに活性化することができ、逆に解糖系を阻害するとATP量が大きく減少することから(③)、エネルギー産生を解糖系に依存していることが示唆された。一方、HepG2細胞は、酸化的リン酸化を阻害した際、Lactate生成量が増加していることから(④)、解糖系の亢進によりエネルギー産生を補おうとしているがATP量は減少している(⑤)、すなわち解糖系を亢進させてもATP産生を補えていないことを意味する。さらに解糖系を阻害した場合よりもATP量が減少する(⑥)ことから、エネルギー産生を解糖系よりも酸化的リン酸化に依存しているということが示唆された。
使用製品
Glycolysis/OXPHOS Assay Kit
<OCR値による評価>
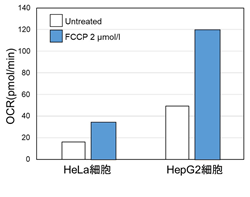
-
同じ細胞数にてミトコンドリア脱共役剤であるFCCP刺激により、細胞の酸素消費を促進した際のOCRを測定した。その結果、HepG2細胞はHeLa細胞よりもOCR値が高く酸化的リン酸化への依存度が大きいことが示唆され、ATP量やLactate量を指標に評価した場合と相関する結果が得られた。
使用製品
Extracellular OCR Plate Assay Kit
|
Science Noteのバックナンバーはこちらから!