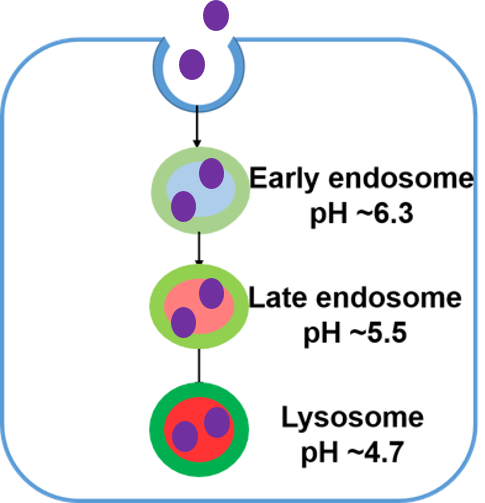
|
近年、細胞の恒常性を保つために細胞小器官間のコミュニケーションが重要であることが明らかになっている。ミトコンドリア-リソソーム接触部位の確立は、2つの細胞小器官間のクロストークを伴い、ミトコンドリア由来小胞(MDVs)の放出に至るが、MDVs分泌のメカニズムはまだ十分に理解されておらず、特にがんや化学療法抵抗性におけるMDVsの役割は未だ明らかではない。本論文では、シスプラチン感受性卵巣癌細胞と比較して抵抗性細胞では、MDVs分泌の増加、後期エンドサイトーシス輸送の障害、RAB7のダウンレギュレーション、EVにおけるRAB7の増加、リソソームおよびミトコンドリアの生合成と代謝回転を司るTFEB-mTOR経路のダウンレギュレーションといった特徴を示すことを明らかにした。また、MDVs分泌の増加がリソソームとミトコンドリアの機能不全により、それらの重要なコミュニケーションが損なわれることが原因である可能性を示しており、ミトコンドリア品質管理(MQC) が損なわれた抵抗性細胞の腫瘍微小環境化中で伝搬することが化学療法抵抗性の原因の1つとなる可能性が示された。これらの結果は、分泌されるEVが化学療法抵抗性の潜在的なマーカーとなることを示唆している。 |
|||
|
Defects of mitochondria-lysosomes communication induce secretion of mitochondria-derived vesicles and drive chemoresistance in ovarian cancer cells |
|||
|
注目ポイント ・シスプラチン化学療法抵抗性細胞は、後期エンドサイトーシス輸送が障害され、RAB7陽性ミトコンドリア由来小胞(MDVs)の分泌が増加するという特徴がある ・MDVsはシスプラチン化学療法抵抗性細胞から分泌され、シスプラチンを細胞外に運搬することができる ・化学療法抵抗性細胞から精製されたMDVsは、RAB7調節過程を介してレシピエント細胞の化学療法抵抗性を誘導する ・MDVsはミトコンドリアに局在し、ミトコンドリア活性を低下させ、ミトコンドリア機能不全、リソソーム欠損を引き起こし、最終的にMDVsを増加させる |
|||
| 関連製品 | |||
|
|||
|
|||
|
|||
|
|||
|
|||
| アプリケーションデータ | |||
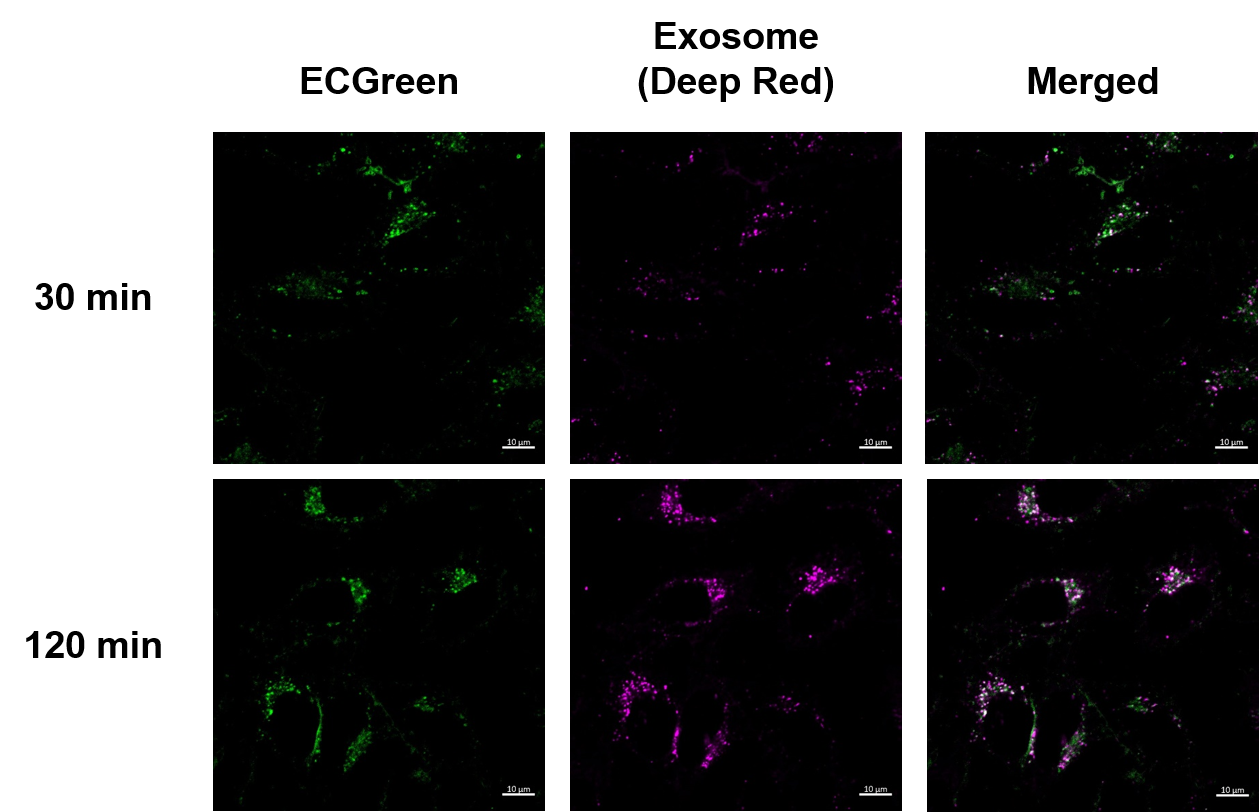
エンドサイトーシス経路を介したエクソソーム取り込みの可視化時間依存的なエンドサイトーシスによるエクソソーム取り込みの様子を可視化しました。結果、ECGreen(製品コード:E296)とExoSparkler Exosome Membrane Labeling Kit-Deep Red(製品コード:EX03)で染色したエクソソームの時間依存的な集積による蛍光強度の増加が確認でき、共局在を示す白色輝点が増加していることが確認出来ました。この結果より、エクソソームはエンドサイトーシスを介して細胞内に取り込まれることが示唆され、エクソソーム本来の挙動を示していることが確認できました。
<観察条件>
<実験操作> |
|||