|
近年、腫瘍内の神経密度とがん転移の関連性が指摘されてきたが、神経がどのようにがんの進行を支えているのかは不明だった。今回、S. Greletらの研究グループは、神経細胞がミトコンドリアをがん細胞へ移行させることで、がんの代謝可塑性と転移能を高めるという新たなメカニズムを明らかにした。
乳がんモデルを用いた実験では、神経遮断によりがんの代謝活性と増殖が顕著に低下し、神経ががんに代謝的支援を行っていることが確認された。さらに、神経とがんを共培養すると、神経からがん細胞へミトコンドリアがトンネル状ナノチューブを介して移動し、受け取ったがん細胞では酸化的リン酸化(OXPHOS)が活性化、ATP産生量や抗酸化能が上昇した。研究チームは新たに開発した遺伝子レポーター「MitoTRACER」により、神経由来ミトコンドリアを受け取ったがん細胞を追跡した。これらの細胞は幹細胞性やストレス耐性が高まり、原発巣よりも転移巣で選択的に濃縮されることが判明した。
これらの結果は、神経が単なる情報伝達経路ではなく、がんの『エネルギー供給者』として転移を支える存在であることを示唆している。
この発見は、腫瘍の神経支配を標的とした新たながん治療戦略の道を拓くものであり、代謝ネットワークの介入による転移抑制の可能性を提示している。
|
|
Nerve-to-cancer transfer of mitochondria during cancer metastasis
論文へのアクセスはこちら: G. Hoover et al., Nature , 2025.
|
|
注目ポイント
・神経細胞がミトコンドリアをがん細胞に移行し、代謝可塑性と転移能を強化する新機構を発見
・MitoTRACERによる追跡で、神経由来ミトコンドリアを受け取った細胞が転移巣で濃縮
・神経遮断ががんのエネルギー代謝を抑制し、神経支配が腫瘍進展の新たな鍵であることを示唆
|
| 関連製品 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| アプリケーションデータ |
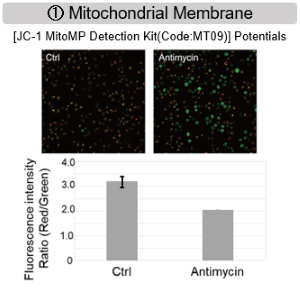
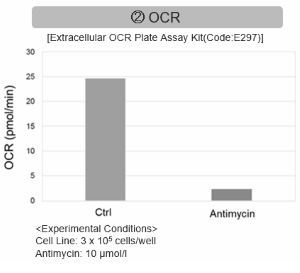
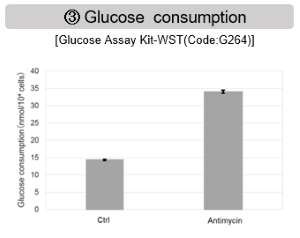
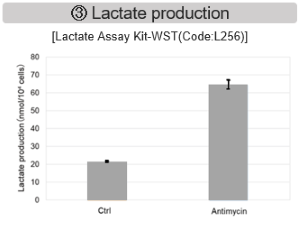
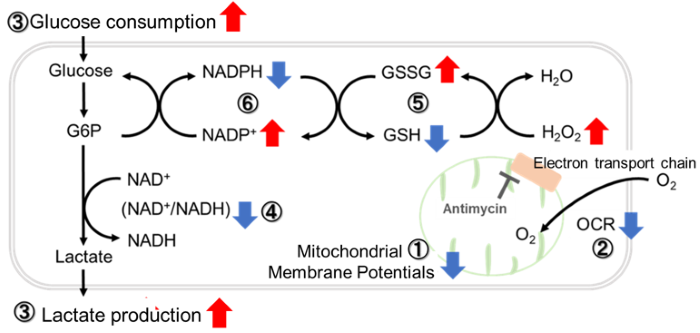
ミトコンドリア電子伝達系の阻害
-
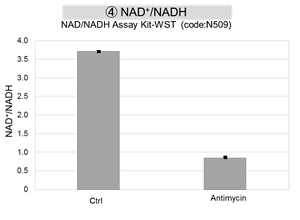
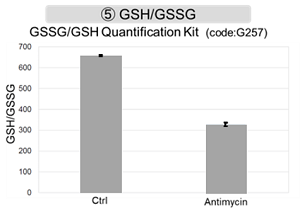
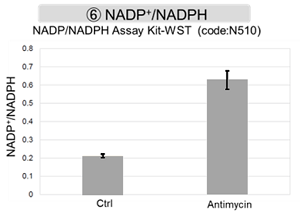
Jurkat細胞にAntimycin刺激を行い、ミトコンドリア電子伝達系を阻害した際の細胞の状態変化を、様々な指標から評価した。
その結果、電子伝達系の阻害により①ミトコンドリア膜電位の低下および②OCRが低下した。また、③解糖系を強制的に維持するために、ピルビン酸から乳酸への代謝が亢進することで、④解糖系全体のNAD+/NADH比が低下し、さらに活性酸素種(ROS)増加に伴う⑤GSH枯渇、グルタチオン生合成に必要なNADPHの減少に伴う⑥NADP+/NADPH比の増加を確認した。
|
2種類のがん細胞における代謝経路の比較
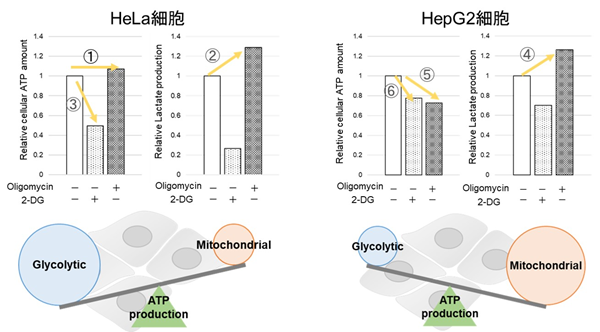
<Lactate生成量とATP量による評価>
-
Oligomycin刺激により酸化的リン酸化でのATP合成を阻害、また2-Deoxy-D-glucose(2-DG)により解糖系でのATP合成を阻害した際のATP量とLactate生成量の変化を確認したところ、HeLa細胞は解糖系に依存し、HepG2細胞は酸化的リン酸化に依存してATP合成している結果が得られた。
HeLa細胞は酸化的リン酸化を阻害した際、ATP量は変わらず(①)、Lactate生成量が増加する(②)ことから、酸化的リン酸化が阻害されても解糖系をさらに活性化することができ、逆に解糖系を阻害するとATP量が大きく減少することから(③)、エネルギー産生を解糖系に依存していることが示唆された。一方、HepG2細胞は、酸化的リン酸化を阻害した際、Lactate生成量が増加していることから(④)、解糖系の亢進によりエネルギー産生を補おうとしているがATP量は減少している(⑤)、すなわち解糖系を亢進させてもATP産生を補えていないことを意味する。さらに解糖系を阻害した場合よりもATP量が減少する(⑥)ことから、エネルギー産生を解糖系よりも酸化的リン酸化に依存しているということが示唆された。
使用製品
Glycolysis/OXPHOS Assay Kit
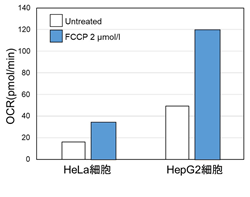
<OCR値による評価>
-
同じ細胞数にてミトコンドリア脱共役剤であるFCCP刺激により、細胞の酸素消費を促進した際のOCRを測定した。その結果、HepG2細胞はHeLa細胞よりもOCR値が高く酸化的リン酸化への依存度が大きいことが示唆され、ATP量やLactate量を指標に評価した場合と相関する結果が得られた。
使用製品
Extracellular OCR Plate Assay Kit
|
Science Noteのバックナンバーはこちらから!