FerroOrange

細胞内鉄イオン測定試薬
-
製品コードF374 FerroOrange
-
CAS番号-
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 tube | ¥18,100 | 342-09533 |
| 3 tubes | ¥40,800 | 346-09531 |
※ 1 tube当たり35 mm dish 17枚分染色可能(終濃度1 μmol/l使用時)
FerroOrangeは、株式会社同仁化学研究所の登録商標です(登録商標第6856078号)
性質
鉄は、生体内で最も多く存在する遷移金属元素であり、様々な生理活性を示すことが報告されています。近年、タンパク質非結合型の鉄イオン(自由鉄)としての存在が注目されており、その高い反応性は細胞損傷や細胞死にも関与していることが示唆されています。自由鉄は安定な化学種である鉄(II)イオン及び鉄(III)イオンとして存在しますが、生細胞内において、細胞内還元的環境、水溶性、トランスポーターの存在等を考慮すると鉄(III)イオンよりも鉄(II)イオンの挙動を知ることが重要であると考えられています。
FerroOrange は、蛍光顕微鏡およびプレートリーダーにて細胞内の鉄を簡便に検出することができます。試薬を培養細胞に添加するだけで細胞膜を透過し、細胞内のFe2+と選択的に反応し強い蛍光を発します。FerroOrangeにはキレート能はありません。FerroOrangeとFe2+は非可逆的に反応するため、Fluo 3のようなカルシウムイオンプローブの検出原理とは異なります。
本製品は、岐阜薬科大学薬化学研究室 永澤秀子先生、平山祐先生のご指導の下、製品化しました。
細胞死関連製品
| 指標 | 製品名 | 測定対象 | 装置 / 検出波長 |
|---|---|---|---|
| 細胞生存能力 | Cell Counting Kit-8 | 細胞内脱水素 酵素活性 |
プレートリーダー 吸光度 λ= 450nm |
| ネクローシス (細胞毒性) |
Cytotoxicity LDH Assay Kit-WST |
遊離LDH | プレートリーダー 吸光度 λ= 490nm |
| アポトーシス | Annexin V Apoptosis Plate Assay Kit |
ホスファチジルセリン | プレートリーダー 蛍光 Ex: 488 nm / Em: 525 nm |
| フェロトーシス | FerroOrange | 細胞内 鉄イオン(Fe2+) |
蛍光顕微鏡, FCM, プレートリーダー 蛍光 Ex: 543 nm / Em: 580 nm |
| フェロトーシス | Lyso-FerroRed | リソソーム内 鉄イオン(Fe2+) |
蛍光顕微鏡, FCM, プレートリーダー 蛍光 Ex: 551 nm / Em: 571 nm |
| フェロトーシス | Mito-FerroGreen | ミトコンドリア内 鉄イオン(Fe2+) |
蛍光顕微鏡 蛍光 Ex: 505 nm / Em: 535 nm |
| フェロトーシス | Liperfluo | 脂質過酸化 | 蛍光顕微鏡, FCM 蛍光 Ex: 488 nm / Em: 500-550 nm |
| フェロトーシス | Iron Assay Kit -Colorimetric- |
組織内鉄イオン (Fe2+, Fe3+) |
プレートリーダー 吸光度 λ= 593nm |
マニュアル
技術情報
鉄検出試薬の選択
鉄検出時の実験方法および測定機器に応じて試薬を選択頂けます。
| FerroOrange | Mito-FerroGreen | |
| 細胞内の局在 | 細胞内 | ミトコンドリア |
| 蛍光特性 | λex : 543 nm、λem : 580 nm | λex : 505 nm、λem : 535 nm |
| 対応装置 (フィルター) |
蛍光顕微鏡、プレートリーダー (Cy3) | 蛍光顕微鏡 (FITC、GFP) |
| 測定対象 | 生細胞 | 生細胞 |
| 染色回数 | 24 μgで35 mm dish 17枚分染色可能 (終濃度 1 μmol/l使用時) |
50 μgで35 mm dish 5枚分染色可能 (終濃度 5 μmol/l使用時) |
技術や使用製品に関する補足
【注目の研究・トピック】
Dojin News No.162
地球上の生命体の活動や疾患における鉄の重要性の再認識 (名古屋大学 豊國 伸哉 先生)
Dojin News No.172
高感度だから内在性の鉄も検出できる
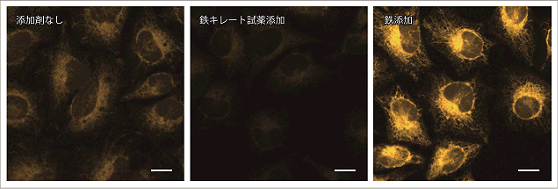
HeLa細胞を用いて、細胞内に内在するFe2+および鉄キレート試薬Bpy(2,2‘-bipyridine、終濃度:100 μmol/l)と鉄(硫酸アンモニウム鉄(II) 、終濃度:100 μmol/l)の添加有無により、細胞内のFe2+の変化をFerroOrangeにより確認しました。
蛍光顕微鏡によるイメージング
鉄キレート試薬を添加することで無刺激の細胞に比べ蛍光強度が低下したことから、細胞内には内在性のFe2+が存在することが確認できました。
<検出条件> Ex: 561 nm、Em: 570-620 nm スケールバー:20 μm
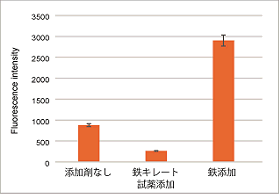
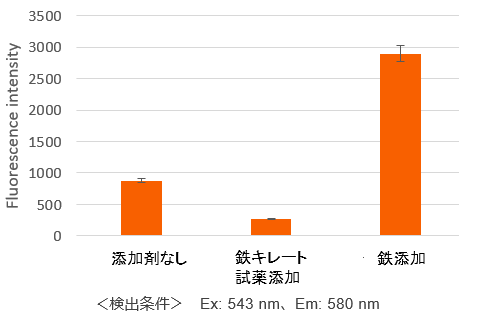
プレートアッセイにより簡便に数値化
鉄キレート試薬および鉄の添加による細胞内のFe2+量の変化を数値データとして確認できました。
<検出条件> Ex: 543 nm、Em: 580 nm
*操作の詳細は よくある質問「プレートリーダーでの測定方法を教えてください。」をご参照ください。
技術や使用製品に関する補足
ーフェロトーシス研究ー
実験例 : アミノ酸トランスポーター(xCT)阻害
【関連試薬】
・過酸化脂質検出試薬
・グルタミン酸測定キット
・グルタチオン測定キット
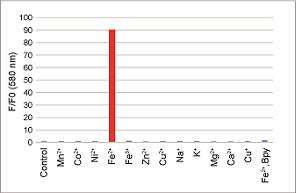
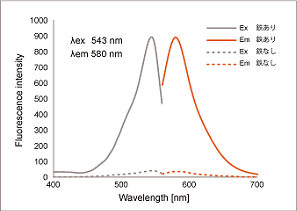
Fe2+への高い選択性
50 mmol/l HEPES Buffer(pH7.4) 1 ml中に1 mmol/l FerroOrange 2 μl、10 mmol/l各種金属 2 μlを加え室温にて1時間反応後の蛍光強度を測定。
<検出条件> Ex: 543 nm、Em: 580 nm
各オルガネラ染色試薬との共染色
FerroOrangeと各種細胞内のオルガネラ染色試薬と共染色しました。
HeLa細胞を各種オルガネラ染色試薬で染色し細胞を洗浄。その後、FerroOrangeを細胞へ添加し蛍光顕微鏡にて観察しました。
ER染色試薬との共染色
FerroOrange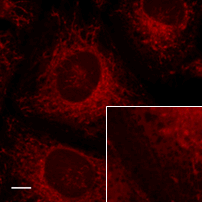 |
ER染色試薬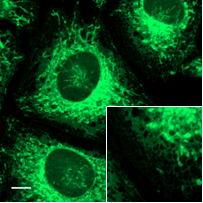 |
Merge |
| <検出条件> | |
| FerroOrange | : Ex: 561 nm、Em: 570-620 nm |
| ER Tracker Green(ER染色試薬) | : Ex: 488 nm、Em: 510-555 nm |
| Scale bars | : 10 μm |
ミトコンドリア染色試薬との共染色
FerroOrange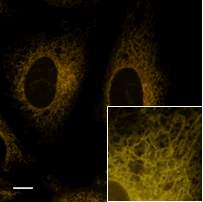 |
ミトコンドリア染色試薬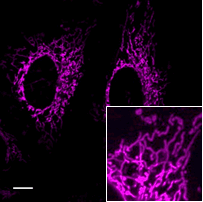 |
Merge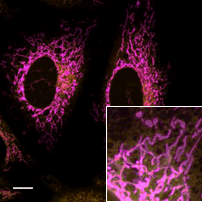 |
| <検出条件> | |
| FerroOrange | : Ex: 561 nm、Em: 570-620 nm |
| MitoBright Deep Red(ミトコンドリア染色試薬) | : Ex: 640 nm、Em: 650-700 nm |
| Scale bars | : 10 μm |
ゴルジ複合体染色試薬との共染色
FerroOrange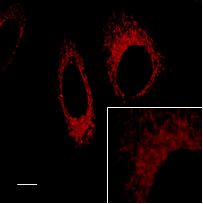 |
ゴルジ複合体染色試薬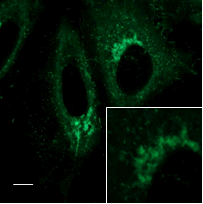 |
Merge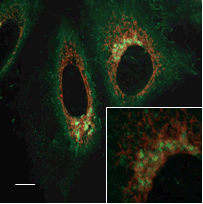 |
| <検出条件> | |
| FerroOrange | : Ex: 561 nm、Em: 570-620 nm |
| BODIPY FL(ゴルジ複合体染色試薬) | : Ex: 488 nm、Em: 510-555 nm |
| Scale bars | : 10 μm |
蛍光特性
50 mmol/l HEPES Buffer (pH7.4) 3 ml中に1 mmol/l FerroOrange 6 μl、10 mmol/l硫酸アンモニウム鉄(Ⅱ)6 μlを加え37℃にて1時間反応後の蛍光強度を測定。
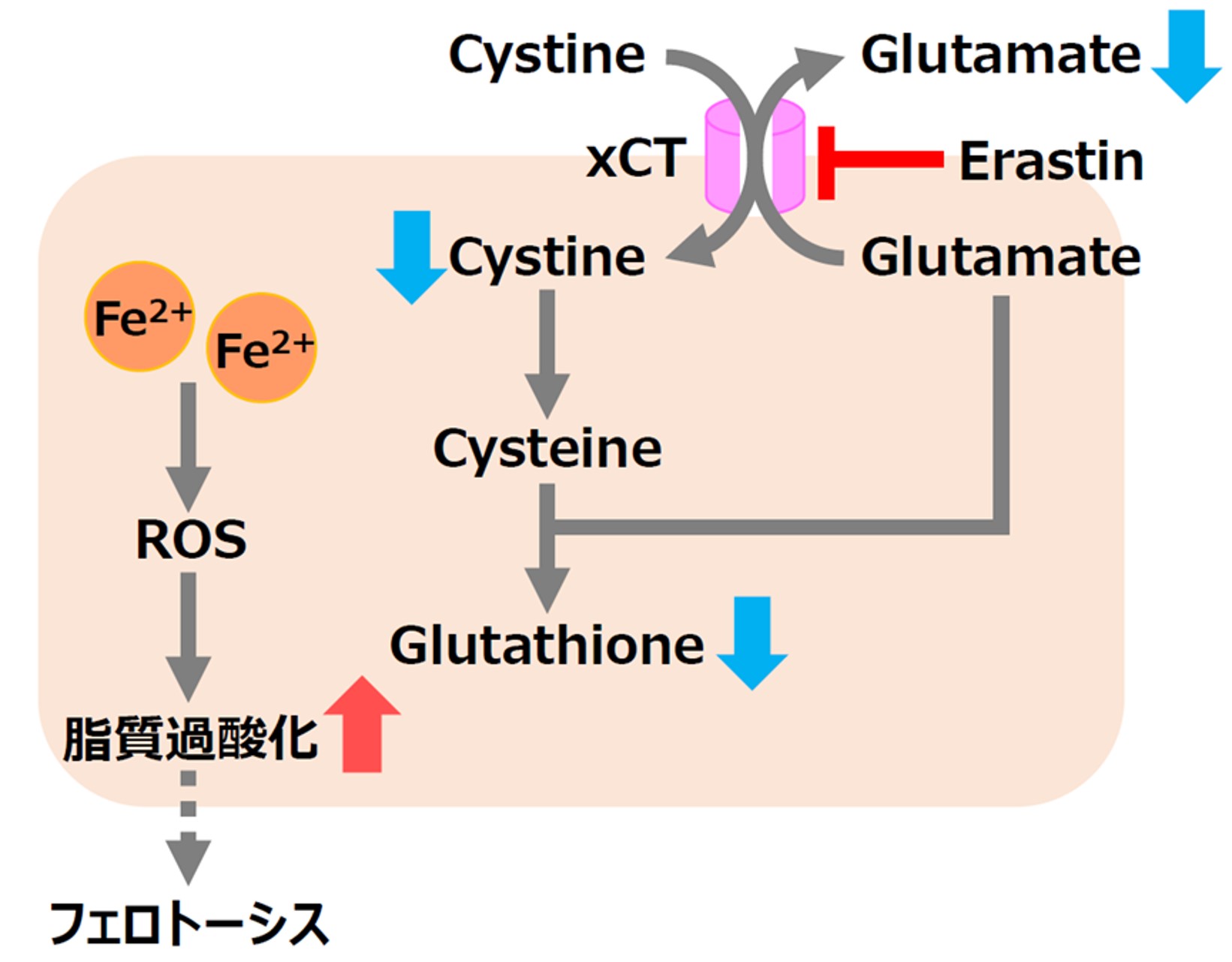
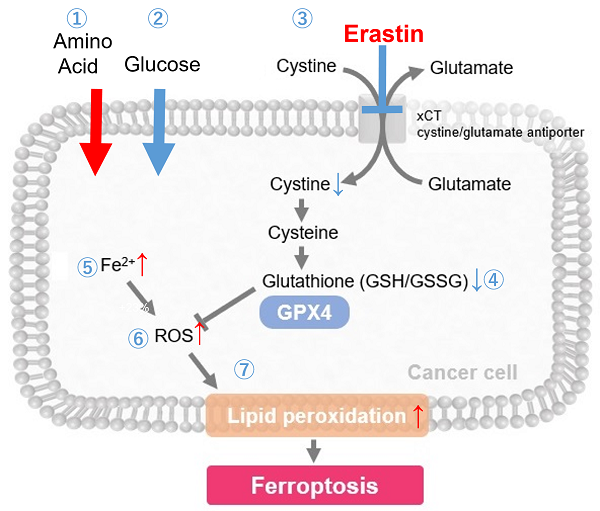
Erastinによるフェロトーシスの誘導
フェロトーシスの誘導剤として知られるErastinは、シスチントランスポーター(xCT)を阻害することで、GSHの原料となるシスチンの取り込みを阻害し、GSH量を減少させます。結果として、脂質過酸化物が増加しフェロトーシスを誘導します。下記の実験例では、Erastin刺激による各指標の変化を小社試薬を用いて確認した事例をご紹介します。
<実験例>
Erastin処理したA549細胞における、栄養素取り込み量の増減と、レドックスバランスの変化を確認しました。
結果、Erastin処理によるxCT阻害によってグルタミン酸の放出量が減少し、シスチンの取り込みが阻害され細胞内グルタチオンの量が減少、更には細胞内のFe2+、ROS、脂質過酸化物の増大が確認されました。
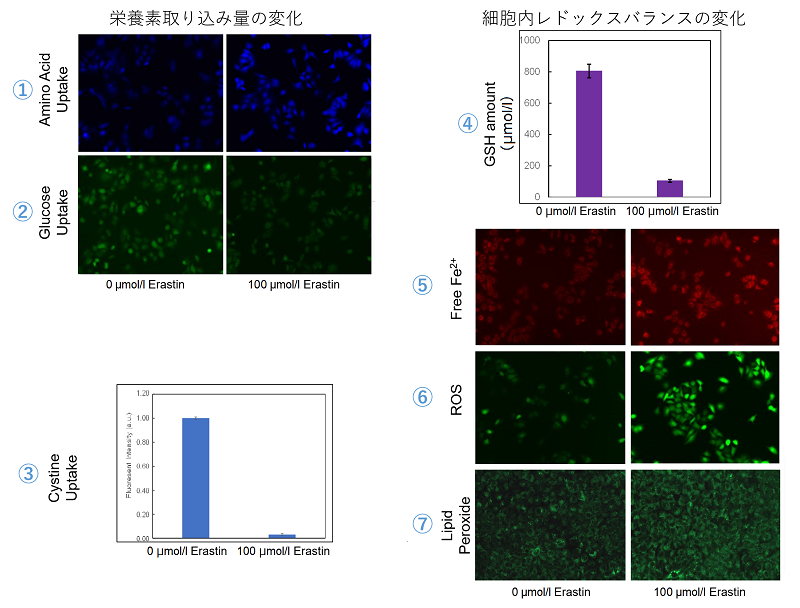
<使用製品>
| ① アミノ酸取り込み | :Amino Acid Uptake Assay Kit (製品コード:UP04) |
| ② グルコース取り込み | :Glucose Uptake Assay Kit-Green (製品コード:UP02) |
| ③ シスチン取り込み | :Cystine Uptake Assay Kit (製品コード:UP05) |
| ④ 細胞内グルタチオン量 | :GSSG/GSH Quantification Kit (製品コード:G257) |
| ⑤ 細胞内鉄イオン | :FerroOrange (製品コード:F374) |
| ⑥ 細胞内トータルROS | :ROS Assay Kit -Highly Sensitive DCFH-DA- (製品コード:R252) |
| ⑦ 細胞内過酸化脂質 | :Liperfluo (製品コード:L248) |
<実験条件>
細胞:A549細胞
培養条件:100 μmol/l Erastin/MEM, 37℃, 3h
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HeLa) |
蛍光顕微鏡 | K. Tomita, M. Fukumoto, K. Itoh, Y. Kuwahara, K. Igarashi, T. Nagasawa, M. Suzuki, A. Kurimasa and T. Sato, "MiR-7-5p is a key factor that controls radioresistance via intracellular Fe2+ content in clinically relevant radioresistant cells.", Biochem Biophys Res Commun.., 2019,doi: 10.1016/j.bbrc.2019.08.117. |
| 2) | 細胞 (ヒト内皮細胞株) |
蛍光顕微鏡 | Y. Wang and M. Tang, "PM2.5 induces ferroptosis in human endothelial cells through iron overload and redox imbalance", Environ. Pollut., 2019, 264, doi: 10.1016/j.envpol.2019.07.105. |
| 3) | 細胞 (MCF7-ADR) |
蛍光顕微鏡 | S Guo, X Yao, Q Jiang, K Wang, Y Zhang, H. Peng, J. Tang and W. Yang , "Dihydroartemisinin-Loaded Magnetic Nanoparticles for Enhanced Chemodynamic Therapy", Front Pharmacol , 2020, 11, 226. |
| 4) | 細胞 (293T) |
蛍光顕微鏡 | R. A. Weber, F. S. Yen, S.P.V. Nicholson, H. Alwaaseem, E.C. Bayraktar,M. Alam, R. C. Timson, K. La, M. Abu-Remaileh, H. Molina and K. Birsoy, "Maintaining Iron Homeostasis Is the Key Role of Lysosomal Acidity for Cell Proliferation", Mol. Cell, 2020, 77, 1-11. |
| 5) | 細胞 (SK-HEP-1) |
蛍光顕微鏡 (解析ソフトを使用し数値化) |
X. Li, T. Wang, X. Huang, Y. Li, T. Sun, S. Zang, K. Guan, Y. Xiong, J. Liu and H. Yuan , "Targeting ferroptosis alleviates methionine‐choline deficient (MCD)‐diet induced NASH by suppressing liver lipotoxicity", Liver Int., 2020, doi:10.1111/liv.14428. |
| 6) | 細胞 (HepG2) |
蛍光顕微鏡 |
T. Hirayama, M. Niwa, S. Hirosawa and H. Nagasawa, "High-Throughput Screening for the Discovery of Iron Homeostasis Modulators Using an Extremely Sensitive Fluorescent Probe", ACS Sens., 2020,doi: 10.1021/acssensors.0c01445. |
| 7) | 細胞、組織 (BV-2細胞、海馬(脳)) |
蛍光顕微鏡 | T. Wu, X. Wang, J. Cheng, X. Liang, Y. Li, M. Chen, L. Kong and M. Tang, "Nitrogen‑doped graphene quantum dots induce ferroptosis through disrupting calcium homeostasis in microglia", Part. Fibre Toxicol., 2022, doi:10.1186/s12989-022-00464-z. |
| 8) | 細胞、組織 (HeLa細胞、子宮頸冷凍スライス) |
蛍光顕微鏡 | T. Wang, M. Gong, Y. Cao, C. Zhao, Y. Lu, Y. Zhou, S. Yao, J. Chen, C. Zhao and R. Ju, "Persistent ferroptosis promotes cervical squamous intraepithelial lesion development and oncogenesis by regulating KRAS expression in patients with high risk-HPV infection", Cell Death Discovery, 2022, doi:10.1038/s41420-022-01013-5. |
よくある質問
-
Q
FerroOrangeで染色する時の注意点を教えて下さい。
-
A
染色時は下記の点に注意の上、使用してください。
①FerroOrange染色後の培地交換
培地交換によりFerroOrangeが細胞外へ漏れ出てしまうため、染色後はそのまま観察してください。②コントロール実験
鉄検出の実験条件を確認するため、鉄キレート試薬Bpy(2,2‘-bipyridine)または鉄(硫酸アンモニウム鉄(II) )を添加したサンプルを準備し、FerroOrangeの蛍光強度の変化をみられることをお勧めします。③細胞が染色されにくい(感度が低い)時の対応
細胞種によって染色度合いに差がみられる場合があります。
FerroOrange working solution濃度を推奨の1 μmol/lより高くして染色を行ってください。1-5 μmol/lの範囲での染色をお勧めします。
-
Q
プレートリーダーでの測定方法を教えてください。
-
A
下記の実験例を参考に測定ください。
<測定サンプル>
サンプルA:添加剤なし(HeLa細胞のみ)
サンプルB:鉄キレート試薬 2,2'-bipyridyl (Bpy) を添加したHeLa細胞
サンプルC:鉄(硫酸アンモニウム鉄)を添加したHeLa細胞<測定操作>
1. 96ウェルマイクロブラックプレート(透明底)にHeLa細胞懸濁液100 μlを 10,000 cells/wellになるよう播種し、37℃インキュベータ(5% CO2)で一晩培養した。
2. サンプルCの細胞をMEM(FBS不含) 100 μlで3回洗浄した。
3. サンプルCのウェルに硫酸アンモニウム鉄(II)/MEM(FBS不含)溶液 100 μL(終濃度:100 μmol/l)を添加し、37℃インキュベーター(5% CO2)中で30分間静置した。
4. 全てのウェルの細胞をHBSS 100 μlで3回洗浄した。
5. サンプルAおよびCのウェルに1 μmol/l FerroOrange working solution 100 μlを添加し、サンプルBのウェルにFerroOrange (終濃度:1 μmol/l)及び Bpy (終濃度:100 μmol/l)を含むHBSS溶液 100 μlを添加し、37℃インキュベータ(5% CO2)で30分間インキュベートした。
6. プレートリーダーにて各サンプルの蛍光強度(Ex: 543 nm、Em: 580 nm)を検出した。<測定データ>
-
Q
推奨のフィルターを教えてください。
-
A
検出時の推奨フィルターは下記の通りです。
励起フィルター: 530-565 nm
蛍光フィルター: 570-620 nm
-
Q
フローサイトメーターによる解析は可能ですか?
-
A
可能です。但し、以下の理由より実験条件の最適化を行う必要があります。
・細胞密度や細胞の種類によっては、FerroOrangeの染色強度に影響を与える場合があります。
・培地交換や洗浄により、色素が細胞外に漏れる場合があります。(参考)
HeLa細胞を用いた実験例をご紹介致します。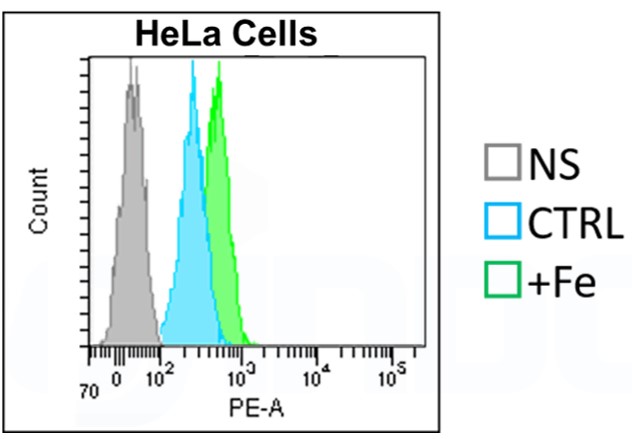
<操作>
1. MEM(10% FBS、1% penicillin-streptomyci)培地に懸濁したHeLa細胞を6ウェルプレートに播種し(1 x105 cells/well)、37℃、5%CO2インキュベーター中で一晩培養した。
2. 細胞を無血清培地(2 ml)で3回洗浄し、無血清培地(1 ml)を細胞に添加した。
3. 10 mmol/l 硫酸鉄(II)アンモニウム(10 μl)をウェルに添加した(終濃度:100 μmol/l)。
4. 硫酸鉄アンモニウムと無血清培地を混合するため、ウェル内の溶液全量を一度マイクロピペットで吸い上げ、再び同じウェルにゆっくり戻した。
5. 37℃、5% CO2インキュベーター中で20分間インキュベートし、HBSS(1 ml)で3回細胞を洗浄した。
6. トリプシン処理(250 µl)後、血清培地(1 ml)で反応を停止し、細胞懸濁液 1.25 mlを遠心管に移した。
7. 細胞懸濁液を1,500 rpm、3分間遠心分離した。
8. 上清を除去し、HBSS(1 ml)を遠心管に加え、ピペッティングにより懸濁した。
9. 細胞懸濁液を1,500 rpmで3分間遠心し、上清を除去した。
10. 無血清培地で希釈した1 μmol/l FerroOrangeを300 μl細胞に添加した。
11. 37℃、5% CO2インキュベーター中で15-30分間インキュベートした。
12. 細胞をセルストレーナーに通し、フローサイトメーターを用いて解析した。<注意点>
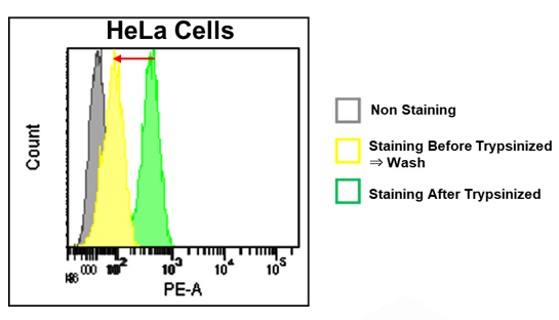
1. 染色後の洗浄によりFerroOrangeが細胞外に漏出するため、染色後洗浄をせずに測定してください。
(染色後の洗浄有無による蛍光強度の差)
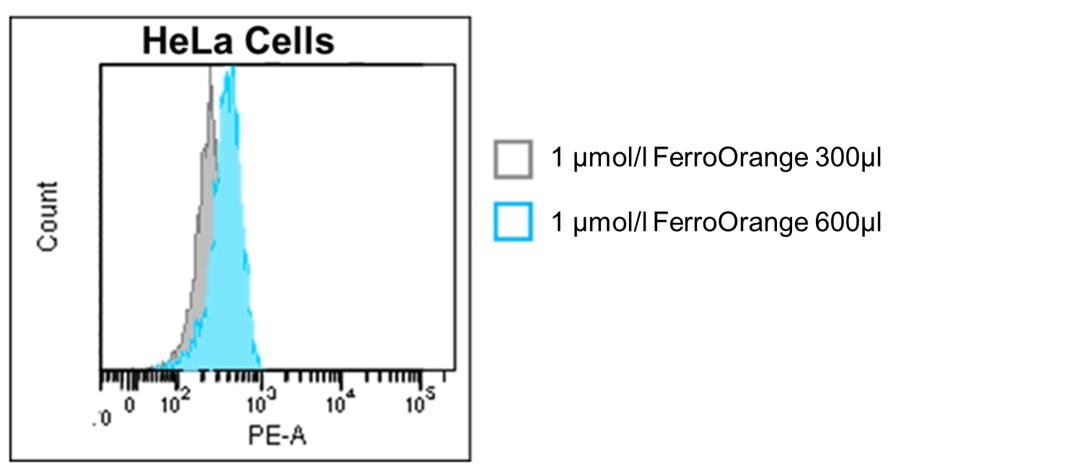
2. 色素溶液の量に依存して蛍光強度が変化することがあるので、等量の色素溶液を添加してください。
(色素溶液量による蛍光強度の差)
3. 鉄(II)を検出する実験条件を確認するために、硫酸鉄(II)アンモニウムを含む試料を調製し、
FerroOrangeの蛍光強度の変化を確認することを推奨します。
-
Q
FerroOrangeは固定細胞に使用できますか?
-
A
固定した場合にはFerroOrangeのシグナルが得られなくなり、正確な細胞内の鉄(II)イオンの変化が確認できなくなるため、推奨いたしません。
( 参考 )
硫酸アンモニウム鉄(II)(終濃度:100 μmol/l)を添加したHepG2細胞を未固定、15分間固定処理、30分間固定処理した細胞にFerroOrange Working solutionを添加し、蛍光顕微鏡にて観察しました。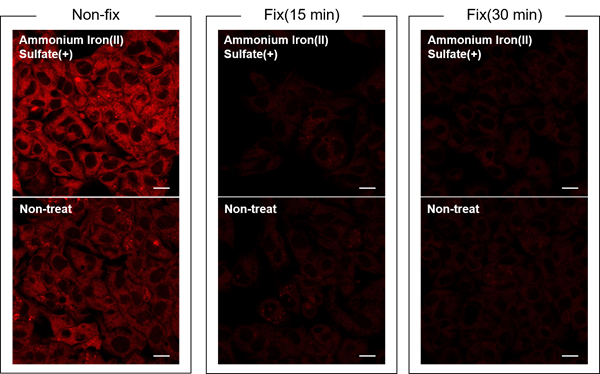
<検出条件>
Ex: 561 nm(1.50 %)
Em: 550-650 nm
Gain: 700 V
Scale bar: 20 µm
-
Q
浮遊細胞への使用は可能ですか?
-
A
可能です。プロトコルは、以下をご参照ください。
【 実験例 】
硫酸アンモニウム鉄(II)(終濃度:100 μmol/l)を添加したJurkat細胞にFerroOrange Working solutionを添加し、蛍光顕微鏡にて観察しました。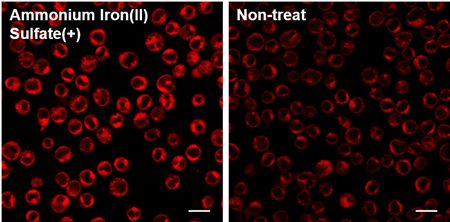
<検出条件>
Ex: 561 nm(1.50 %)
Em: 550-650 nm
Gain: 700 V
Scale bar: 20 µm
<プロトコル>
➀ 3×106 cells/mlのJurkat細胞懸濁液(無血清MEMを使用)をディッシュに播き、10 mmol/l 硫酸アンモニウム鉄(II)溶液を添加した。(終濃度 100 µmol/l)
➁ インキュベーター内(37 ℃, 5 ℃, 5 %CO2存在下)で30 分間インキュベートした。
➂ 1.5 ml tubeに移して遠心し、上清を除去後、HBSSで1回洗浄した。
④ 遠心し上清を除去後、1 µmol/l FerroOrange working solutionを添加し、ibidi 8-well plateに移した。
⑤ インキュベーター内(37℃, 5℃, 5%CO2存在下)で30 分間インキュベートした。
⑥ 蛍光顕微鏡で観察した。
-
Q
S/Nが小さいのですが、考えられる原因はありますか?
-
A
血清の影響が考えられます。
血清入りの培地を使用した場合、無血清の培地と比較してバックグラウンドが上昇することを確認しております。
( 参考 )
10 µM Erastinで24時間処理したA549細胞に、血清入り培地、無血清培地でそれぞれ調整したFerroOrange Working solutionを添加し、蛍光顕微鏡にて観察しました。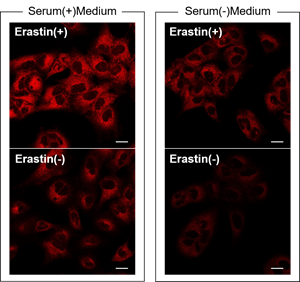
<検出条件>
Ex: 561 nm(1.50 %)
Em: 550-650 nm
Gain: 700 V
Scale bar: 20 µm
取扱条件
| 性状: | 本品はアセトニトリル、メタノール、ジメチルスルホキシドに溶解する。 |
|---|---|
| 純度(HPLC): | 92.0% 以上 |
| 蛍光スペクトル: | 試験適合 |
| 保存条件: 冷蔵,遮光 |