MitoBright ROS Deep Red - Mitochondrial Superoxide Detection

ミトコンドリア スーパーオキシド検出用蛍光色素
本製品は [製品コード:MT14] の製品名称変更品です。
- ミトコンドリアスーパーオキシドを長波長励起(Deep Red)で検出可能
- 緑色や赤色の蛍光色素と共染色が可能
- スーパーオキシドとの選択性が高い
-
製品コードMT16 MitoBright ROS Deep Red - Mitochondrial Superoxide Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 nmol | ¥24,100 | 341-10191 |
性質
ミトコンドリアでは ATP を合成する際に活性酸素種の一つであるスーパーオキシドが発生しています。 正常な状態の細胞であれば、抗酸化能が働き発生した活性酸素を無毒化しますが、ミトコンドリア機能異常が起こると活性酸素が過剰に発生 し、細胞に様々な機能不全を引き起こします。このような細胞の酸化ストレスを議論する際に、細胞内の活性酸素やミトコンドリア膜電位とミトコンドリアの活性酸素を同時解析するニーズが増えてきております。
MitoBright ROS Deep Redはミトコンドリア内のスーパーオキシドと選択的に反応し、さらに既存品よりも長波長の蛍光を発するため、困難であった緑や赤色の蛍光特性を持つミトコンドリア膜電位検出色素等との共染色が可能です。
マニュアル
技術情報
既存試薬との比較
活性酸素種に対する反応選択性
MitoBright ROS Deep Redと既存品(T社)の各活性酸素種(ROS)に対する反応性を比較しました。既存品と比べてMitoBright ROS Deep Redはスーパーオキシド選択性が高いことが確認されました。
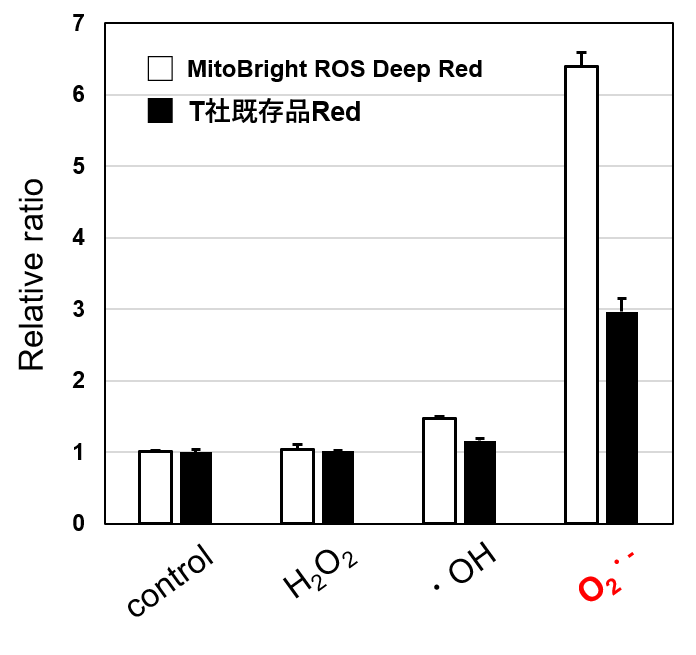
また、MitoBright ROS Deep Redは既存品よりも長波長の蛍光を発するため、これまで困難であったミトコンドリア膜電位染色色素(JC-1色素MT09, TMRE, MT-1色素MT13)との共染色が可能です。
| MitoBright ROS Deep Red | 既存試薬(T社) | |
| 製品形態 | 固体 | 固体 |
| 生細胞染色 | 〇 | 〇 |
| 染色後の固定化 | × | × |
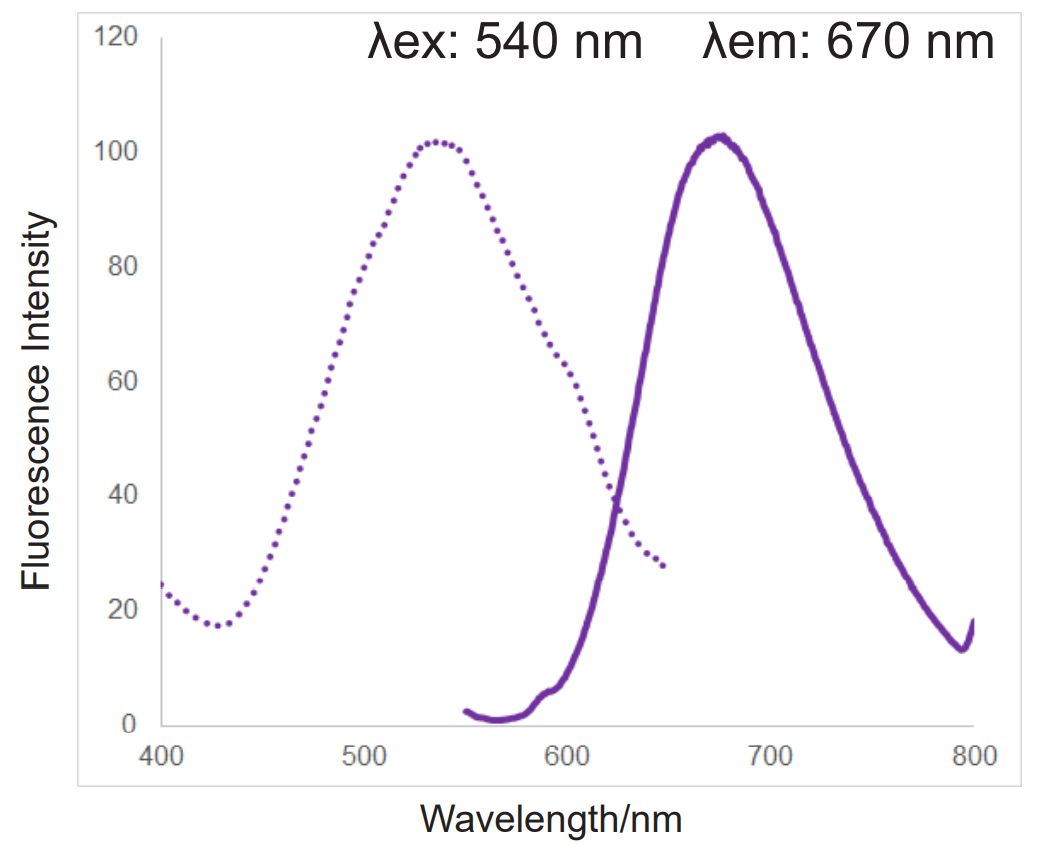
| 蛍光特性 | λex:540 nm , λem:670 nm | λex:510 nm , λem:580 nm |
実験例:ミトコンドリアスーパーオキシドと膜電位の同時測定
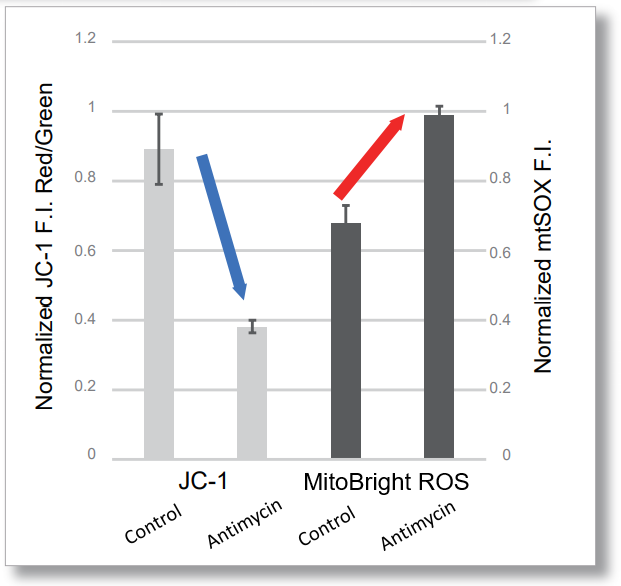
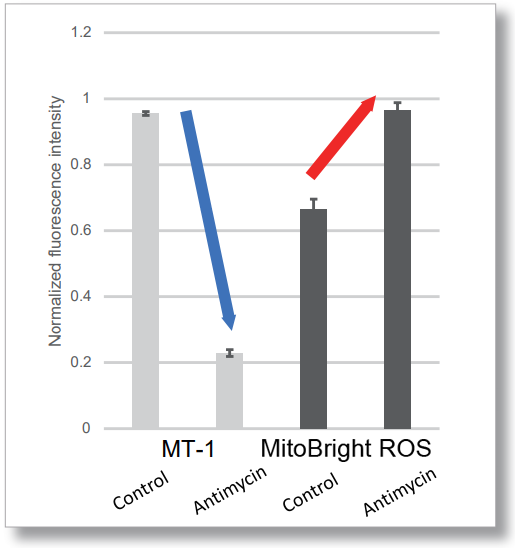
HeLa細胞をHBSSにて洗浄後、MitoBright ROS Deep Redと小社ミトコンドリア膜電位染色色素(JC-1 : 製品コードMT09もしくはMT-1: 製品コードMT13)を用いて共染色し、発生したミトコンドリアROSと膜電位を同時に観察しました。
その結果、いずれの条件でもミトコンドリアROSの発生に伴うミトコンドリア膜電位の低下を同時に観察することが出来ました。
<JC-1を用いた実験操作>
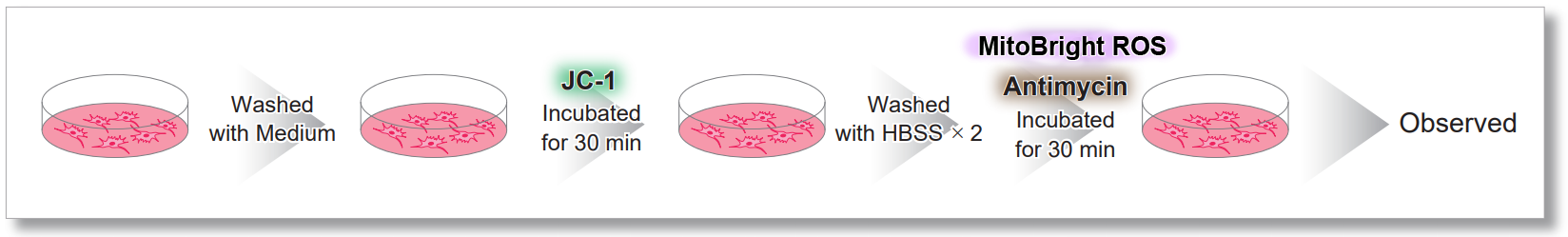
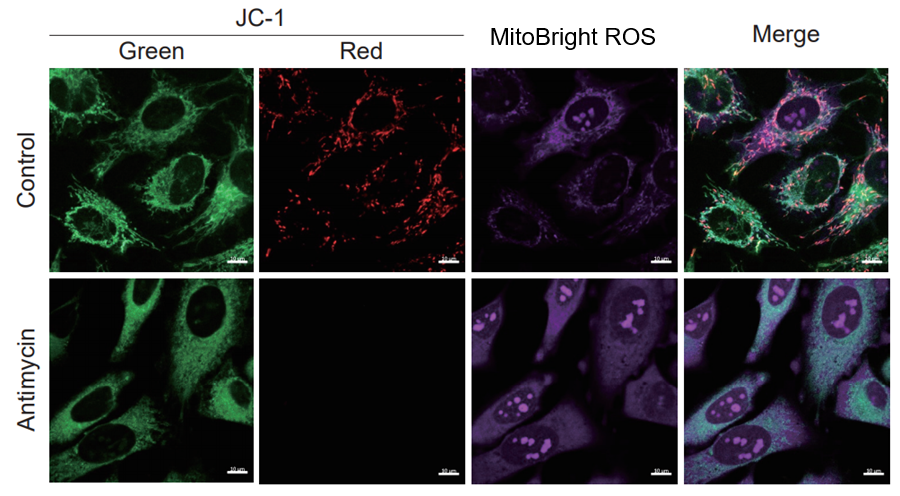
検出条件(共焦点レーザー蛍光顕微鏡)
JC-1 :緑 Ex = 488, Em = 490-520 nm, 赤 Ex = 561, Em = 560-600 nm
MitoBright ROS :Ex = 633 nm, Em = 640-700 nm
スケールバー:10 µm
検出条件(マイクロプレートリーダー)Tecan, Infinite M200 Pro
JC-1 :緑 Ex = 480-490 nm, Em = 525-545 nm, 赤 Ex = 530-540 nm, Em = 585-605 nm
MitoBright ROS :Ex = 545-555 nm, Em = 665-685 nm
<MT-1を用いた実験操作>
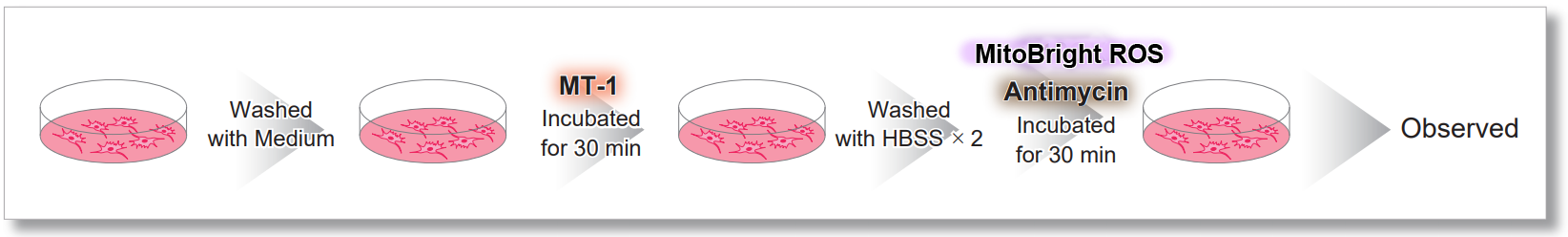
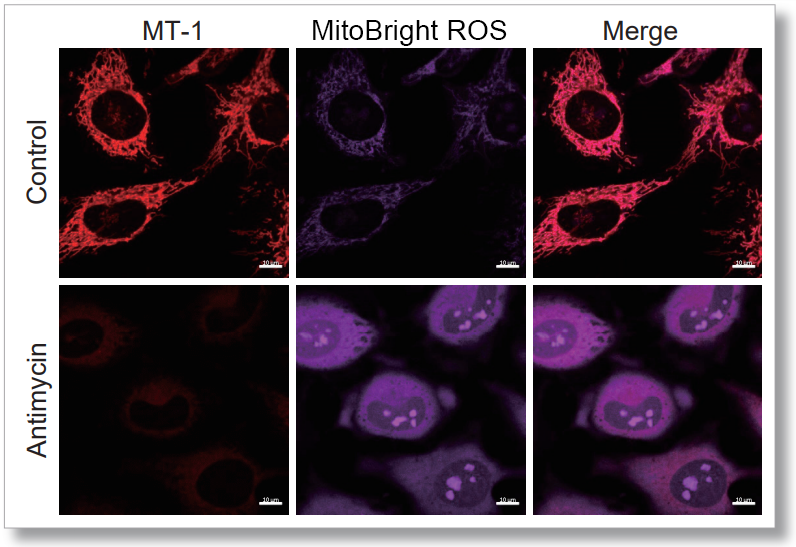
検出条件(共焦点レーザー蛍光顕微鏡)
MT-1: Ex = 561, Em = 560-600 nm
MitoBright ROS: Ex = 633 nm, Em = 640-700 nm
スケールバー:10 µm
検出条件(マイクロプレートリーダー)Tecan, Infinite M200 Pro
MT-1: Ex = 540-550 nm, Em = 590-610 nm (Gain = 200)
MitoBright ROS :Ex = 545-555 nm, Em = 665-685 nm
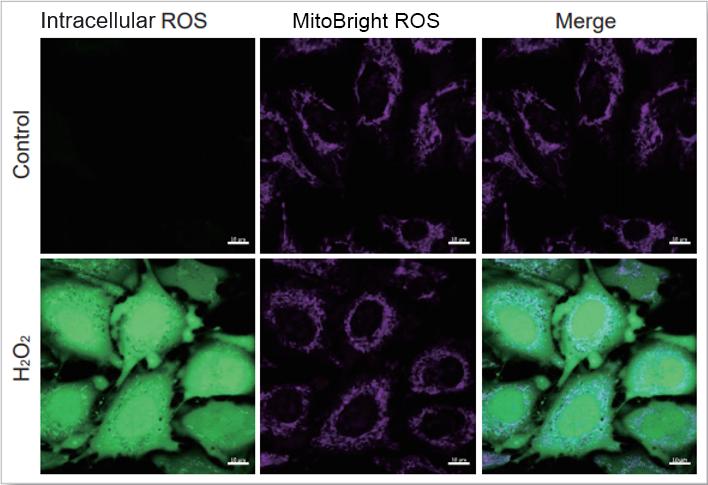
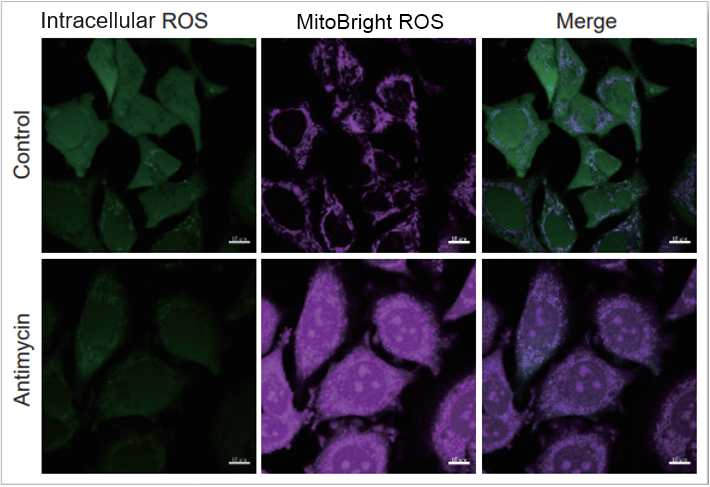
実験例:細胞内Total ROSとミトコンドリアスーパーオキシドの同時測定
HeLa細胞をHBSSにて洗浄後、MitoBright ROS Deep Redと小社細胞内ROS検出色素(ROS Assay Kit –Highly Sensitive DCFH-DA-:製品コード R252)を用いて共染色し、ミトコンドリアスーパーオキシド発生剤(Antimycin)もしくは過酸化水素による異なる刺激を誘導し、観察を行いました。
その結果、細胞全体でのROS 誘導とミトコンドリア由来の ROS誘導を見分けることが観察できました。
実験操作
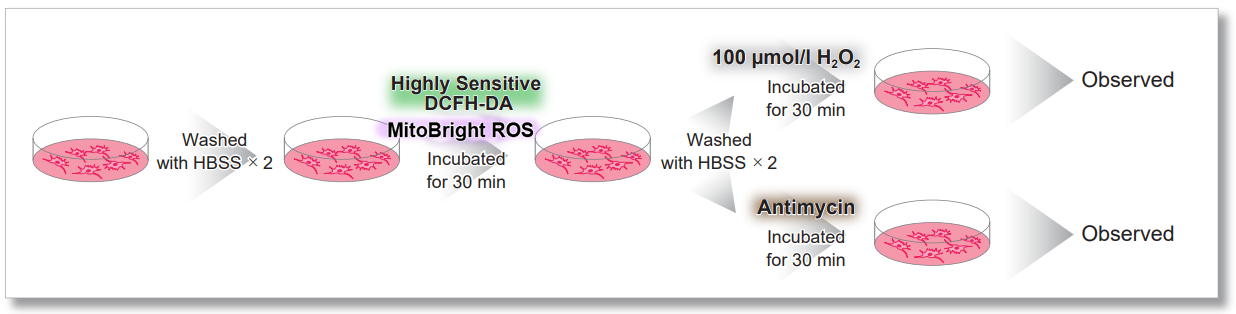
過酸化水素刺激の結果
Antimycin刺激の結果
検出条件(共焦点レーザー蛍光顕微鏡)
細胞内 ROS: Ex = 488, Em = 490-520 nm
MitoBright ROS :Ex = 633 nm, Em = 640-700 nm
スケールバー:10 µm
実験例:ミトコンドリア量、ミトコンドリア膜電位、ミトコンドリアスーパーオキシドの同時解析
核染色試薬(Hoechst33342: 製品コードH342)とミトコンドリア量検出色素(MitoTrackerTM Green FM)、ミトコンドリア膜電位検出色素(Tetramethylrhodamine ethyl ester (TMRE))を用いて染色したHeLa細胞をHBSSにて洗浄後、Antimycinを含むMitoBright ROS Deep Red working solutionを用いて染色し、発生したミトコンドリアROSと膜電位、ミトコンドリア量、核を同時に観察しました。
その結果、ミトコンドリア量の変化が無い状態で、ミトコンドリアROSの発生に伴うミトコンドリア膜電位の低下を同時に観察することが出来ました。
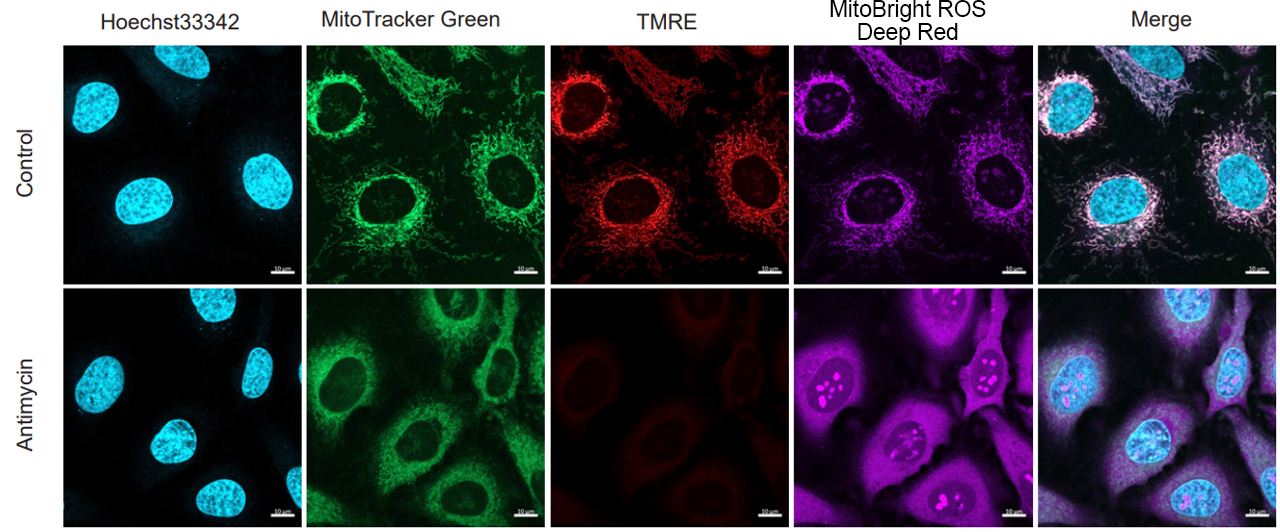
<検出条件>
検出器:共焦点レーザー顕微鏡
(青)核:Hoechst33342 (Ex = 405 nm, Em = 450-495 nm)
(緑)ミトコンドリア量:MitoTrackerTM Green FM (Ex = 488 nm, Em = 500-550 nm)
(赤)ミトコンドリア膜電位:TMRE (Ex = 561 nm, Em = 560-620 nm)
(紫)ミトコンドリアスーパーオキシド:MitoBright ROS Deep Red (Ex = 633 nm, Em = 640-700 nm)
スケールバー:10 µm
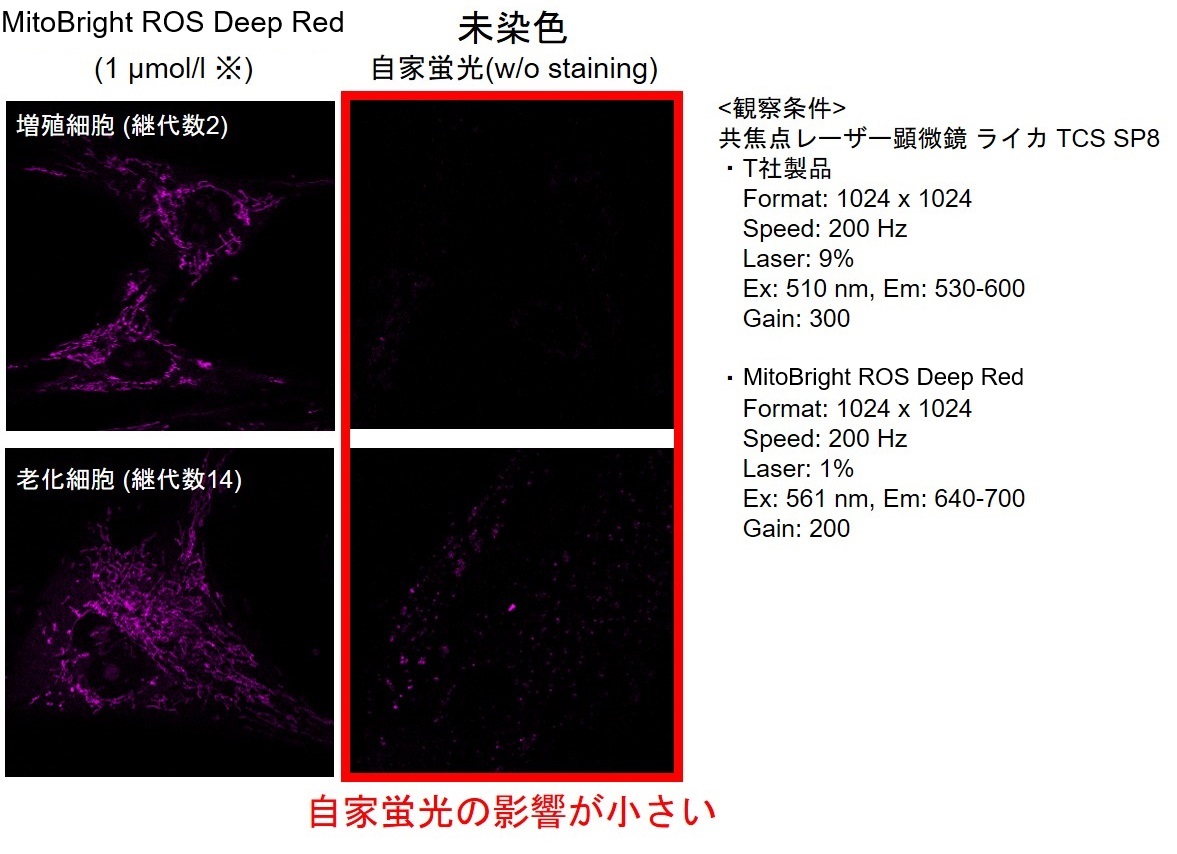
実験例:老化細胞のミトコンドリアのスーパーオキシドを検出する
-自家蛍光(リポフスチン)の影響を極力抑えて観察するコツ-
細胞老化研究におけるリポフスチンの影響
老化した細胞は、リポフスチンと呼ばれるリソソームで分解しきれなかった酸化損傷タンパク質やミトコンドリアが不溶性物質としてリソソームに蓄積することが知られており、蛍光観察時のバックグラウンド上昇の要因となります。細胞老化研究ではリポフスチン等を含む自家蛍光の影響を極力抑えて観察する必要があります。
試薬による違い
老化細胞のミトコンドリアのスーパーオキシドを検出する際の試薬による自家蛍光の影響の違いについてご紹介します。T社製品と小社MitoBright ROS Deep Red - Mitochondrial Superoxide Detectionを用い、TIG-1細胞(ヒト胎児肺由来線維芽細胞)の増殖細胞(継代数2)と老化細胞(継代数14)のミトコンドリアのスーパーオキシドを観察しました。
その結果、T社製品(染色濃度:5 μmol/l)の場合、増殖細胞と老化細胞共にミトコンドリア由来の糸状の蛍光以外に球状の蛍光が多く観察されました。この球状の蛍光は、未染色の細胞の観察画像より自家蛍光であることがわかりました。一方でMitoBright ROS Deep Red(染色濃度:1 μmol/l)を用いた場合は、自家蛍光の影響が少ない状態でミトコンドリアのスーパーオキシド由来の蛍光を観察できました。このことから、特に老化細胞を蛍光観察する際は、色素の感度や波長、蛍光顕微鏡の波長などを考慮して自家蛍光を極力抑えて対象を観察することが重要であることがわかりました。
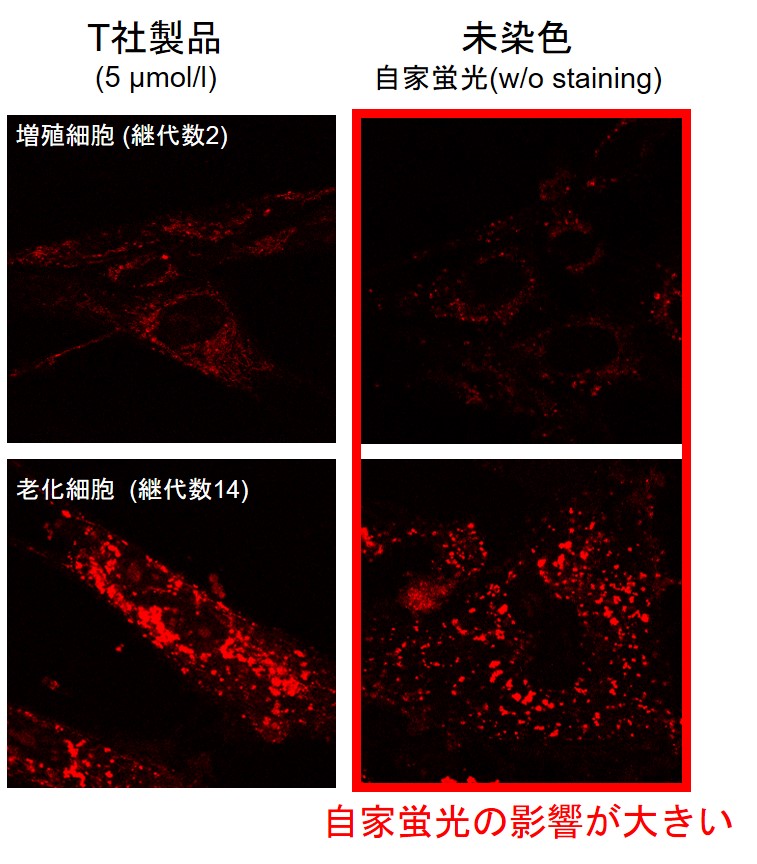
※細胞によってMitoBright ROSの至適濃度が異なります。染色濃度による自家蛍光の影響の違いについては、
よくある質問 老化細胞を観察するとミトコンドリア以外の蛍光が観察されます。何を気を付ければいいですか?をご覧ください。
<データ提供>
地方独立行政法人東京都健康長寿医療センター 藤田 泰典 先生
<参考文献>
Y. Fujita, M. Iketani, M. Ito and I. Ohsawa, “Temporal changes in mitochondrial function and reactive oxygen species generation during the development of replicative senescence in human fibroblasts", Exp. Gerontol., 2022, 165, 111866.
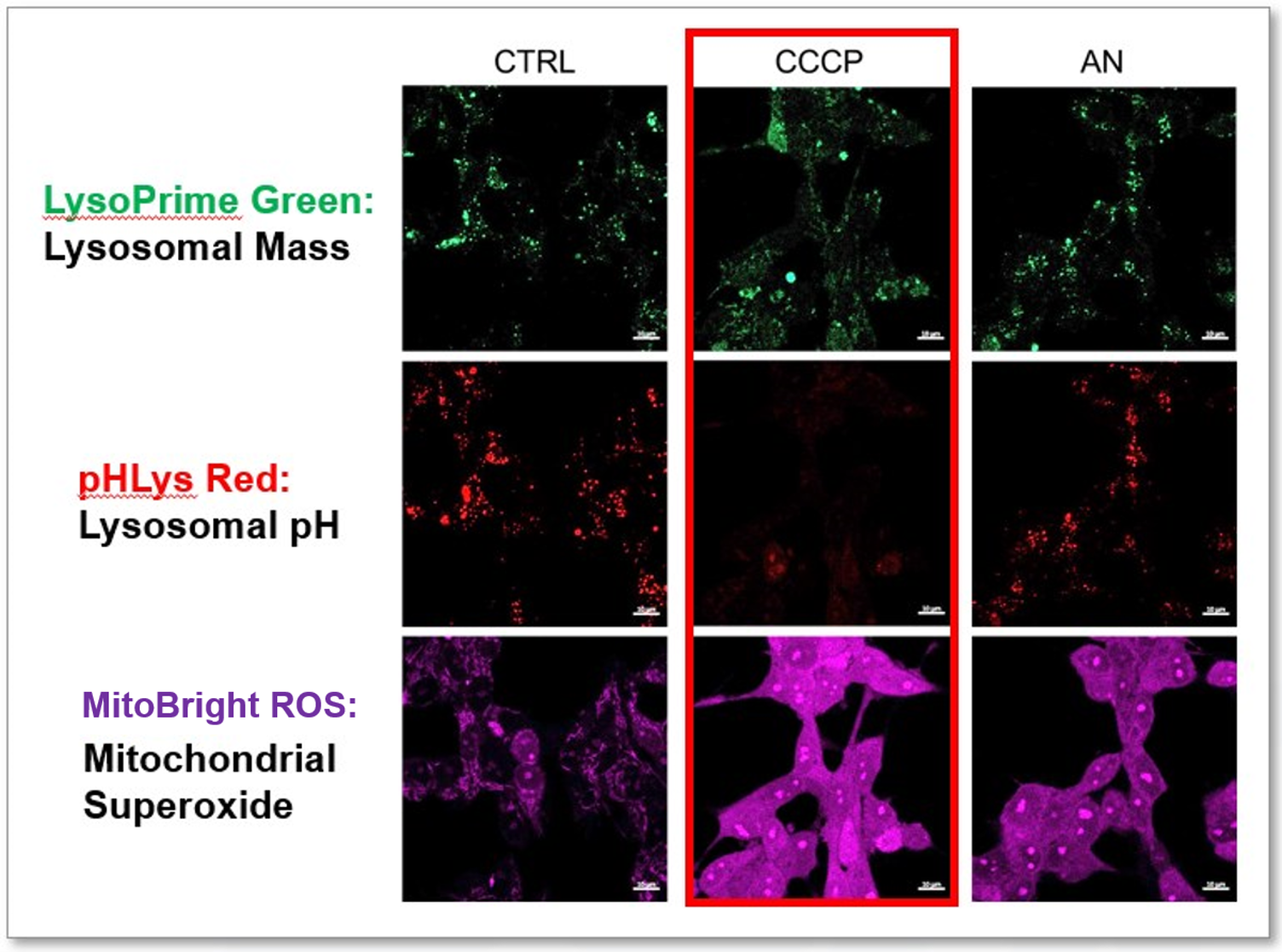
実験例:リソソーム機能とミトコンドリアスーパーオキシドの同時測定
CCCPとアンチマイシン(AN)は、ミトコンドリア膜電位の喪失に関連するミトコンドリアROSの誘導因子として知られています。最近の研究では、CCCPはミトコンドリアROSだけでなく、リソソーム機能障害も誘発することが示されています。
本実験では、ミトコンドリアROSを観察するために、HeLa細胞をミトコンドリアスーパーオキシド検出用のMitoBright ROS Deep Redで染色し、リソソームの量とpHはLysoPrime GreenおよびpHLys Redでそれぞれ検出しました。MitoBright ROSとリソソーム染色試薬の共染色により、CCCPはアンチマイシンとは異なり、ミトコンドリアROSの誘導と同時にリソソームの中性化を引き起こすことが明らかになりました。
参考文献: B. S. Padman, et. al., Autophagy (2013)
<使用製品>
リソソーム機能検出:Lysosomal Acidic pH Detection Kit (製品コード:L266)
ミトコンドリアROS検出:MitoBright ROS - Mitochondrial Superoxide Detection (製品コード:MT16)
蛍光特性
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (ラット腎近位尿細管細胞) |
蛍光顕微鏡 | D. Sun, S. Cui, H. Ma, P. Zhu, N. Li, X. Zhang, L. Zhang, L. Xuan, J. Li, "Salvianolate ameliorates renal tubular injury through the Keap1/Nrf2/ARE pathway in mouse kidney ischemia-reperfusion injury", 2022, J. Ethnopharmacol., doi:10.1016/j.jep.2022.115331. |
| 2) | 細胞 TIG-1 Cell (老化研究用) ヒト胎児肺由来線維芽細胞 |
蛍光顕微鏡 | Y. Fujita, M. Iketani, M. Ito, I. Ohsawa, "Temporal changes in mitochondrial function and reactive oxygen species generation during the development of replicative senescence in human fibroblasts", 2022, doi:10.1016/j.exger.2022.111866. |
| 3) | 細胞 (MIN6-M9) |
蛍光顕微鏡 | R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, "Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER", 2022, iScience, doi:10.1016/j.isci.2022.104603. |
| 4) | 細胞 (内皮細胞) |
蛍光顕微鏡 | A. Patel, M. Simkulet, S. Maity, M. Venkatesan, A. Matzavinos, M. Madesh & B. R. Alevriadou, "The mitochondrial Ca2+ uniporter channel synergizes with fluid shear stress to induce mitochondrial Ca2+ oscillations", 2022, Sci. Rep., doi:10.1038/s41598-022-25583-7. |
| 5) | 細胞 (BV2) |
蛍光顕微鏡 | Y. Yan, R. Zheng, Y. Liu, Y. Ruan, Z. Lin, N. Xue, Y. Chen, B. Zhang, J. Pu , "Parkin regulates microglial NLRP3 and represses neurodegeneration in Parkinson's disease", Aging Cell, 2023, doi:10.1111/acel.13834. |
| 6) | 細胞 (B細胞) |
フローサイトメーター | Y. F. Yazicioglu, E. Marin, C. Sandhu, S. Galiani, I. G. A. Rza, Mohammad Ali, B. Kronsteiner, E. B. Compeer, M. Attar, S. J. Dunachie, M. L. Dustin, A. J. Clarke, "Dynamic mitochondrial transcription and translation in B cells control germinal center entry and lymphomagenesis", Nat. Immunol., 2023, doi:10.1038/s41590-023-01484-3. |
よくある質問
-
Q
使用回数の目安を教えてください。
-
A
使用回数の目安は以下をご参考ください。
・96-well plate: 1枚
・ibidi 8-well plate: 6枚
・35 mm dish: 5枚
-
Q
MitoBright ROS Deep Redの検出原理を教えてください。
-
A
MitoBright ROS Deep Redはスーパーオキシド選択的に酸化され発蛍光する色素です。
さらに、本色素は膜電位依存的に細胞内のミトコンドリアに局在するため、ミトコンドリアのスーパーオキシドを特異的に検出することができます。
スーパーオキシド誘導に伴いミトコンドリアの膜電位が消失する場合、反応後の色素は核小体や細胞質に分散します。
-
Q
培地以外でWorking solutionの調製は可能ですか?
-
A
可能です。培地以外でしたらHBSSやPBSをご使用いただけます。
-
Q
検出可能な検出器と適切なフィルターを教えてください。
-
A
共焦点レーザー顕微鏡、落射型蛍光顕微鏡、プレートリーダーで検出可能です。
・共焦点レーザー顕微鏡
Ex/Em: 561/640-700 nm (赤色色素と共染色しない場合)
Ex/Em: 633/640-700 nm (赤色色素と共染色する場合)・落射型蛍光顕微鏡
TxRedフィルター
Ex/Em: 540-580/590-670 nm・プレートリーダー
Ex/Em: 535–565/660–690 nm
-
Q
共染色時の注意点を教えてください。
-
A
本試薬はストークシフトが長い蛍光特性を持ちます。そのため、ご使用の前に本試薬と共染色試薬の蛍光波長を必ずご確認の上、適切な励起・検出波長に設定してください。
-
Q
刺激後の染色は可能ですか?
-
A
ミトコンドリア膜電位が低下しない条件であれば可能です。
本色素は膜電位依存的にミトコンドリアに集積します。そのため刺激により膜電位が低下する場合は、刺激後の染色ではミトコンドリアに集積できず正確なスーパーオキシドの検出ができません。
上記特徴から、小社では刺激前染色を推奨しております。
-
Q
老化細胞を観察するとミトコンドリア以外の蛍光が観察されます。何を気を付ければいいですか?
-
A
以下の2点をご確認ください。
(1)観察条件
染色した細胞と未染色の細胞を準備し、自家蛍光が出来るだけ少ない条件で観察してください。(2)染色濃度
細胞によってMitoBright ROSの至適濃度が異なります。1~10 μmol/lの範囲を目安にご検討ください。(参考)
TIG-1細胞(ヒト胎児肺由来線維芽細胞, 継代数14)を1, 10 μmol/l MitoBright ROSにて染色し観察したところ、1 μmol/lの方がより自家蛍光の影響が少ない状態で観察できました。
<データ提供>
地方独立行政法人東京都健康長寿医療センター 藤田 泰典 先生



















