SPiDER-βGal
β-galactosidaseの検出試薬
-
製品コードSG02 SPiDER-βGal
-
CAS番号1824699-57-1
-
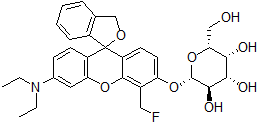
化学名(2S,3R,4S,5R,6R)-2-{[3'-(Diethylamino)-5'-(fluoromethyl)-3H-spiro(isobenzofuran-1,9'-xanthen)-6'-yl]oxy}-6-(hydroxymethyl)tetrahydro-2H-pyran-3,4,5-triol
-
分子式・分子量C31H34FNO8=567.60
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 20 μg x 3 | ¥55,200 | 343-09161 |
SPiDER-βGalは、株式会社同仁化学研究所・株式会社東京大学TLOの登録商標です(登録商標第6331186号)
性質
大腸菌由来のβ-galactosidase遺伝子(lacZ)は、レポータージーンアッセイマーカーとして幅広く用いられている。代表的なβ-galactosidaseの検出方法として、X-gal染色が広く利用されているが、細胞膜透過性が乏しいため、細胞や組織を固定化する必要がある。また、従来のβ-galactosidase検出蛍光試薬は細胞内滞留性が低いため、β-galactosidase未発現細胞と発現細胞を明瞭に区別できないことが課題であった。
これらの課題を克服するため、浦野、神谷らは細胞膜透過性と細胞内滞留性を有する新たな蛍光試薬SPiDER-βGalの開発に成功した1)。本試薬は、β-galactosidaseとの酵素反応により、キノンメチドと呼ばれる中間体を形成して、近傍のタンパク質中のSH基等の求核性基と安定な共有結合を形成し、蛍光性になる。このように、反応した試薬が細胞内タンパク質に固定化されることで優れた細胞内滞留性を有し、その結果、β-galactosidase発現細胞を一細胞レベルで明確に検出することが可能となる。
老化細胞検出用試薬の選択ガイド
| 製品名 | サンプル | 対応装置 | 色素 / 検出波長 |
| 生細胞 固定化細胞 |
 |
SPiDER-βGal |
|
| Cellular Senescence Detection Kit- SPiDER Blue |
固定化細胞 |  |
SPiDER-Blue Ex: 350-450 nm / Em: 400-500 nm |
| SPiDER-βGal | 組織 |  |
SPiDER-βGal Ex: 500-540 nm / Em: 530-570 nm |
| Cellular Senescence Plate Assay Kit- SPiDER-βGal |
生細胞 |  |
SPiDER-βGal |
技術情報
原理
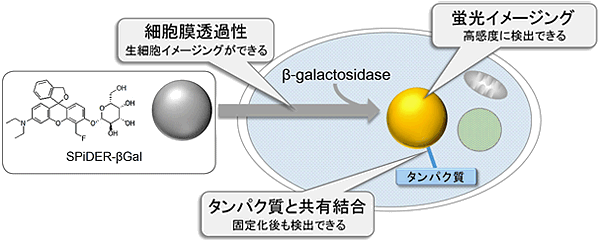
図1 SPiDER-βGalの細胞染色原理
SPiDER-βGal は生細胞膜を透過した後、細胞中のβ-galactosidaseによる酵素反応を受け、その中間体はタンパク質中の求核性基と共有結合を形成することで細胞内に滞留する。
染色操作
| 試薬添加 | 染色(15分間) | 観察 |
 |
||
| 準備した細胞をバッファーで洗浄後、SPiDER-βGalを添加 | 15分間インキュベート(遮光下)後、細胞をバッファーにて洗浄 | 蛍光顕微鏡またはフローサイトメトリーにて蛍光観察 |
組織の蛍光イメージング
|
|
その他の詳細データ |
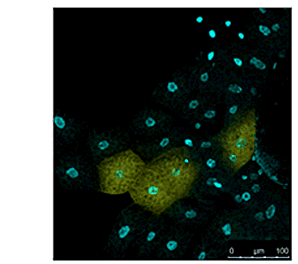
図3 ショウジョウバエ組織のライブイメージング
( データ提供:東京大学大学院医学系研究科 浦野泰照教授)
生細胞・固定化細胞の蛍光イメージング
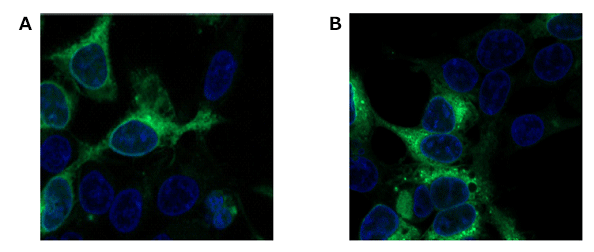
図4 HEK/LacZ細胞とHEK細胞の細胞数比1:1試料のSPiDER-βGalによる染色画像
A. 生細胞、B. 固定化細胞(4%PFA/PBS)
(緑:SPiDER-βGal由来、青:Hoechst 33342)
HEK293 細胞およびβ- ガラクトシダーゼ安定発現HEK/LacZ 細胞を1:1 となるように混合培養し、固定化前後でSPiDER-βGal による染色を行い共焦点顕微鏡で観察した。SPiDER-βGal の膜透過性と細胞内滞留性により固定化前後ともに蛍光イメージングができることが確認された。
フローサイトメトリーによるβ- ガラクトシダーゼ発現細胞の検出
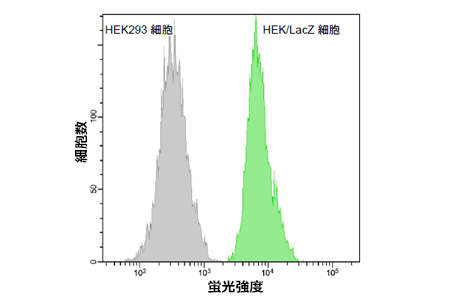
図5 HEK/LacZ細胞とHEK細胞のSPiDER-βGalによるフローサイトメトリーでの分別測定
HEK293 細胞およびβ- ガラクトシダーゼ安定発現HEK/LacZ細胞を1:1 となるよう混合培養し、SPiDER-βGal による染色後にフローサイトメトリーにて測定した。SPiDER-βGal が細胞内に滞留することにより、β-galactosidase 安定発現株(緑色)と未発現株(灰色)を分別することが可能となった。
組織サンプル中のSA-β-gal検出
糖尿病モデルマウスの組織サンプルを用い、SPiDER-βGalによりSA-β-galを検出した論文が公開されました。
<組織サンプルの染色条件>
急速凍結した組織をスライス後、4%パラホルムアルデヒドに浸し20分間、室温でインキュベート。その後、PBSにて洗浄したサンプルに20 μmol/L SPiDER-βGalを加え1時間37℃でインキュベート。最後にサンプルをPBSにて洗浄し観察。
実験操作およびデータの詳細は下記参考文献の5)を参照ください。
蛍光特性
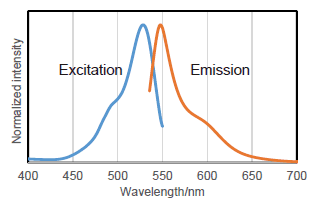
図2 β-galactosidaseと反応後のSPiDER-βGalの励起・蛍光スペクトル
<推奨フィルター>
励起:500 ~ 540 nm
蛍光:530 ~ 570 nm
共焦点レーザー顕微鏡およびフローサイトメーターでは、
488 nm 励起により検出した実績があります。
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞・組織 (腸管幹細胞・幼虫の翼盤) |
蛍光顕微鏡 | T. Doura, M. Kamiya, F. Obata, Y. Yamaguchi, T. Y. Hiyama, T. Matsuda, A. Fukamizu, M. Noda, M. Miura, Y. Urano, "Detection of LacZ-Positive Cells in Living Tissue with Single-Cell Resolution.", Angew Chem Int Ed Engl., 2016, doi: 10.1002/anie.201603328. |
| 2 | 細胞 (内分泌細胞) |
蛍光顕微鏡 | H. Omori, S. Ogaki, D. Sakano, M. Sato, K. Umeda, N. Takeda, N. Nakagata, S. Kume, "Changes in expression of C2cd4c in pancreatic endocrine cells during pancreatic development.", FEBS Lett., 2016, doi: 10.1002/1873-3468.12271. |
| 3 | 細胞 (SHIN3; SKOV3; OVCAR3) |
蛍光顕微鏡/フローサイトメーター | Y. Nakamura, A. Mochida, T. Nagaya, S. Okuyama, F. Ogata, P. L. Choyke, H. Kobayashi, "A topically-sprayable, activatable fluorescent and retaining probe, SPiDER-βGal for detecting cancer; Advantages of anchoring to cellular proteins after activation", Oncotarget., 2017, doi: 10.18632/oncotarget.17080. |
| 4 | 組織 (マウス腎臓) |
蛍光顕微鏡 | S. Lu, S. Liu, A. Wietelmann, B. Kojonazarov, A. Atzberger, C. Tang, R. T. Schermuly, H. J. Gröne, S. Offermanns, "Developmental vascular remodeling defects and postnatal kidney failure in mice lacking Gpr116 (Adgrf5) and Eltd1 (Adgrl4)", PLoS ONE., 2017, 10.1371/journal.pone.0183166. |
| 5 | 組織 (マウス脂肪組織) |
蛍光顕微鏡 | T. Sugizaki, S. Zhu, G. Guo, A. Matsumoto, J. Zhao, M. Endo, H. Horiguchi, J. Morinaga, Z. Tian, T. Kadomatsu, K. Miyata, H. Itoh & Y. Oike, "Treatment of diabetic mice with the SGLT2 inhibitor TA-1887 antagonizes diabetic cachexia and decreases mortality", NPJ Aging Mech Dis., 2017, DOI:10.1038/s41514-017-0012-0. |
| 6 | 細胞 (VZ/SVZ) |
フローサイトメーター | Y. Nakatani, H. Kiyonari and T. Kondo, "Ecrg4 deficiency results in extended replicative capacity of neural stem cells in a Foxg1-dependent manner", Development., 2019, doi: 10.1242/dev.168120. |
| 7 | 細胞 (アフリカツメガエル; 卵母細胞) |
蛍光顕微鏡 | A. A.Tokmakov AA and K. I. Sato, "Activity and intracellular localization of senescence-associated β-galactosidase in aging Xenopus oocytes and eggs.", Exp. Gerontol.., 2019, 119, 157. |
| 8 | 細胞 (マウス初代平滑筋細胞) |
蛍光顕微鏡/フローサイトメーター | Y. Han, T. Bedarida, Ye Ding, Q. Wang, P. Song, and M. H. Zou, "β-Hydroxybutyrate Prevents Vascular Senescence through hnRNP A1-Mediated Upregulation of Oct4", Molecular Cell., 2019, 71, 1064–1078. |
| 9 | 細胞 (内皮細胞) |
蛍光顕微鏡 | A. J. Barinda, K. Ikeda, D. B. Nugroho, D. A. Wardhana, N. Sasaki, S. Honda, R. Urata, S. Matoba, K. Hirata and N. Emoto, "Endothelial progeria induces adipose tissue senescence and impairs insulin sensitivity through senescence associated secretory phenotype", Nat. Commun., 2020, 11, 481. |
| 10 | 組織 (マウス筋組織) |
蛍光顕微鏡 | Y. Saito, T. Chikenji, T. Matsumura, M. Nakano, and M. Fujimiya, "Exercise enhances skeletal muscle regeneration by promoting senescence in fibro-adipogenic progenitors", Nat. Commun., 2020, doi:10.1038/s41467-020-14734-x. |
| 11 | 細胞 (ヒト臍帯静脈内皮細胞) |
フローサイトメーター | M. Suda, I. Shimizu, G. Katsuumi, Y. Yoshida, Y. Hayashi, R. Ikegami, N. Matsumoto, Y. Yoshida, R. Mikawa, A. Katayama, J. Wada, M. Seki, Y. Suzuki, A. Iwama, H. Nakagami, A. Nagasawa, R. Morishita, M. Sugimoto, S. Okuda, M. Tsuchida, K. Ozaki, M. Nakanishi-Matsui and T. Minamino, "Senolytic vaccination improves normal and pathological age-related phenotypes and increases lifespan in progeroid mice", Nature Aging, 2021, doi:10.1038/s43587-021-00151-2. |
| 12 | 細胞 (MG63 cells) |
蛍光顕微鏡 | H. Nakashima, M. Yasunaga, M. Yoshida, M. Yamaguchi, S. Takahashi, H. Kajiya, S. Tamaoki, and J. Ohno, "Low Concentration of Etoposide Induces Enhanced Osteogenesis in MG63 Cells via Pin1 Activation", J. Hard Tissue Biol., 2021, doi:10.2485/jhtb.30.175. |
| 13 | 細胞 (マウス筋肉細胞) |
蛍光顕微鏡 | V. Moiseeva, A. Cisneros, V. Sica, O. Deryagin, Y. Lai, S. Jung, E. Andres, J. An, J. Segales, L. Ortet, V. Lukesova, G. Volple, A. Benguria, A. Dopazo, S. Aznar-Benitah, Y. Urano, A. d. Sol, M. A. Esteban, Y. Ohkawa, A. L. Serrano, E. Perdiguer & P. Munoz-Canoves, "Senescence atlas reveals an aged-like inflamed niche that blunts muscle regeneration", Nature, 2022, doi:10.1038/s41586-022-05535-x. |
よくある質問
-
Q
既存法に対する利点を教えてください。また、既存法との相関性はありますか?
-
A
①生細胞に適用できます。同様に生細胞に適用できるGFP融合タンパク質発現細胞を用いて相関性があることを確認しました。
②GFP法と比べて固定化後も蛍光観察ができます。
③既存の低分子β-ガラクトシダーゼ蛍光検出試薬と比較して、「細胞膜透過性」及び「細胞内滞留性」が優れるため、β-ガラクトシダーゼ発現細胞のみを一細胞レベルで染色できます。
-
Q
Working solutionは、Hanks' HEPES以外でも調製できますか?
-
A
PBS, HBSSなどが使用できます。
-
Q
Working solutionは、どのくらい安定ですか?
-
A
保存できません。調整した日のうちに使用してください。
-
Q
フローサイトメーターで使用可能ですか?
-
A
使用できます。β-ガラクトシダーゼ発現および未発現のHEK細胞の混合試料をフローサイトメーターで測定して、測り分けすることができました。取扱説明書に手順と条件を記載しています。
-
Q
固定後、試料の染色はできますか?
-
A
可能です。 4%パラホルムアルデヒドやメタノールで固定化しても蛍光観察ができます。固定化によりβ-ガラクトシダーゼ活性は低下しますので、固定化条件の検討を行ってください。
-
Q
推奨フィルターを教えてください。
-
A
以下のフィルターを推奨します。
・蛍光顕微鏡: 励起(500-540 nm), 蛍光(500-540 nm)
・フローサイトメーター: 励起(488 nm), 蛍光(500-540 nm)取扱説明書の「励起/蛍光スペクトル」及び「上記フィルターを用いた蛍光顕微鏡測定例」もご参考ください。
-
Q
染色後、試料の固定はできますか?
-
A
可能です。 4%パラホルムアルデヒドやメタノールで固定化しても蛍光観察ができます。
-
Q
組織染色は可能ですか?
-
A
可能です。細胞染色と比べてWorking solution濃度を高くして染色条件をご検討ください(10-20 μmol/Lを目安)。