細胞老化とミトコンドリア
細胞老化とミトコンドリアの関係
-
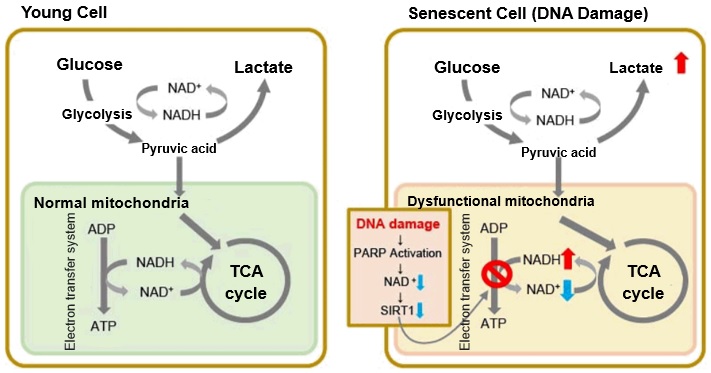
老化した細胞では、ミトコンドリアの機能障害により、ATPは主に嫌気的解糖経路で生成され、乳酸産生の増加につながります2)。DNA損傷は、細胞老化におけるミトコンドリア機能不全の原因の一つでとして知られている。DNA損傷の蓄積はDNA修復機構を活性化し、NAD+の消費を増加させます。NAD+レベルの低下は、ミトコンドリア機能維持に重要な因子であるSIRT1活性を低下させ、ミトコンドリア機能の障害(電子伝達の阻害→ATP産生/NAD+レベルの低下)につながります1),3)。
参考文献:
1. J. Wu, Z. Jin, H. Zheng and L. Yan, “Sources and implications of NADH/NAD+redox imbalance in diabetes and its complications”, Diabetes Metab. Syndr. Obes., 2016, 9, 145
2. Z. Feng, R. W. Hanson, N. A. Berger and A. Trubitsyn, “Reprogramming of energy metabolism as a driver of aging”, Oncotarget., 2016, 7(13), 15410.
3. S. Imai and L. Guarente, “NAD+ and sirtuins in aging and disease”, Trends in Cell Biology, 2014, 24(8), 464.
-
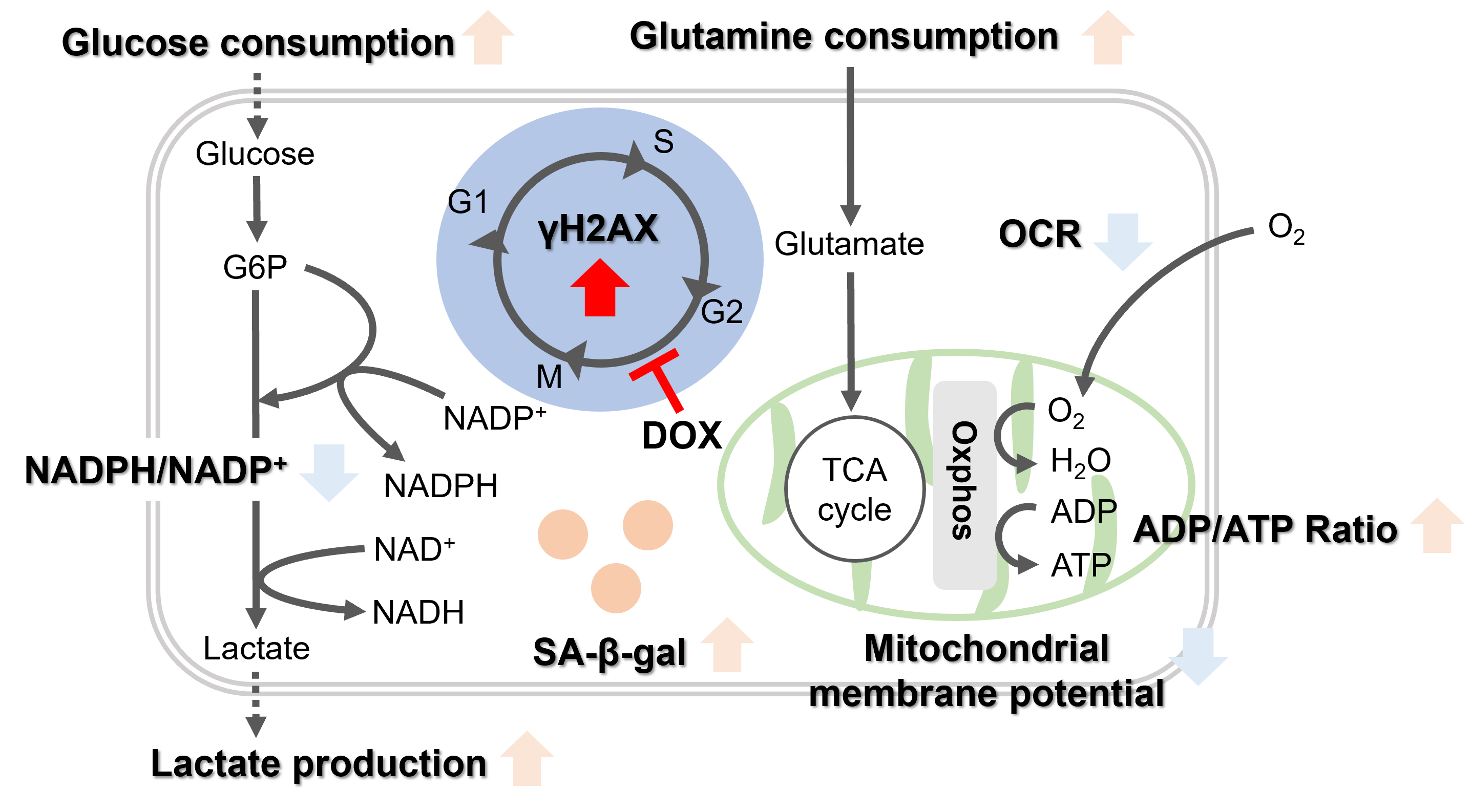
酸化ストレス & 老化促進: ①SA-β-gal ミトコンドリア機能不全: ③ Mitochondrial membrane potential ④ Oxygen consumption rate (OCR)
-
解糖系とグルタミン代謝の活性化: ⑥ Glucose consumption ⑦ Lactate production ⑧ Glutamine consumption
-
抗酸化力の低下: ⑨ NADPH/NADP+ ratio
-
DNA修復:
論文情報:ミトコンドリア機能と老化
| 題名 | Neuronal induction of BNIP3-mediated mitophagy slows systemic aging in Drosophila Schmid, E. et al., Nature Aging, 2022, 2, 494-507 |
| 要点 |
1. ショウジョウバエの脳では、加齢によってミトコンドリア量が増加する一方で、マイトファジーが減少する。 2. 成体神経系でBNIP3を誘導するとマイトファジーが誘導され、老化脳における機能不全ミトコンドリアの蓄積が抑制される。 3. 神経系でBNIP3を誘導すると、マイトファジーが促進され、生物の寿命と健康寿命が延長する。 4. 神経系におけるBNIP3を介したマイトファジーは、老化したハエの筋肉と腸の恒常性を改善する。 |
| 題名 |
Mitochondrial contribution to lipofuscin formation |
| 要点 |
1. 老化した細胞におけるマイトファジーの障害は、ミトコンドリアの量とスーパーオキシドの形成を増加させる。さらに、ミトコンドリアの分裂を阻害すると、リポフスチンの形成も増加する。 2. Lonプロテアーゼのダウンレギュレーションは、リポフスチン形成の増加と関連しているが、ミトコンドリアを標的とした抗酸化剤mitoTEMPOの塗布は、これらのタンパク質凝集体の蓄積を防ぐ。 |
| 題名 | Age-associated changes in human CD4+ T cells point to mitochondrial dysfunction consequent to impaired autophagy Bektas, A. et al., Aging, 2019, 11(21), 9234-9263 |
| 要点 |
1. 加齢はCD4+Tリンパ球における持続的なミトコンドリア機能障害と関連しており、マイトファジーのターンオーバーにおける欠陥は慢性炎症を誘発し、高齢者における免疫防御の障害につながる可能性がある。 2. これらの結果は、ミトコンドリアの機能障害、マイトファジーの障害、加齢との関連を強調し、細胞の加齢や加齢関連疾患におけるミトコンドリアの品質管理の重要な役割を裏付けている。 |
過酸化脂質の蓄積と細胞老化およびミトコンドリアとの関係
脂質毒性は細胞内脂質の蓄積によって引き起こされ、ミトコンドリアの機能不全を示します。脂質毒性は細胞老化を促進し、癌の発生にも影響を及ぼします。
参考論文
1. Clara, C. al., “Mitochondria: Are they causal players in cellular senescence?”, Biochimica et Biophysica Acta – Bioenergetics, 2015, 1847(11), 1373-1379.
2. Huizhen, Z. et al., “Lipidomics reveals carnitine palmitoyltransferase 1C protects cancer cells from lipotoxicity and senescence”, Journal of Pharmaceutical Analysis, 2020.
3. Xiaojuan, H. et al., “Astrocyte Senescence and Alzheimer’s Disease: A Review”, Front. Aging Neurosci., 2020.
4. Borén, J. et al., “Apoptosis-induced mitochondrial dysfunction causes cytoplasmic lipid droplet formation”, Cell Death Differ, 2012, 19(9), 1561-1570.
5. Na, L. et al., “Aging and stress induced β cell senescence and its implication in diabetes development”, Aging (Albany NY), 2019, 11(21), 9947–9959.
ミトコンドリアとリソソーム、そして鉄による老化制御
|
| 関連製品 |
|
|
|
|
|
|
|
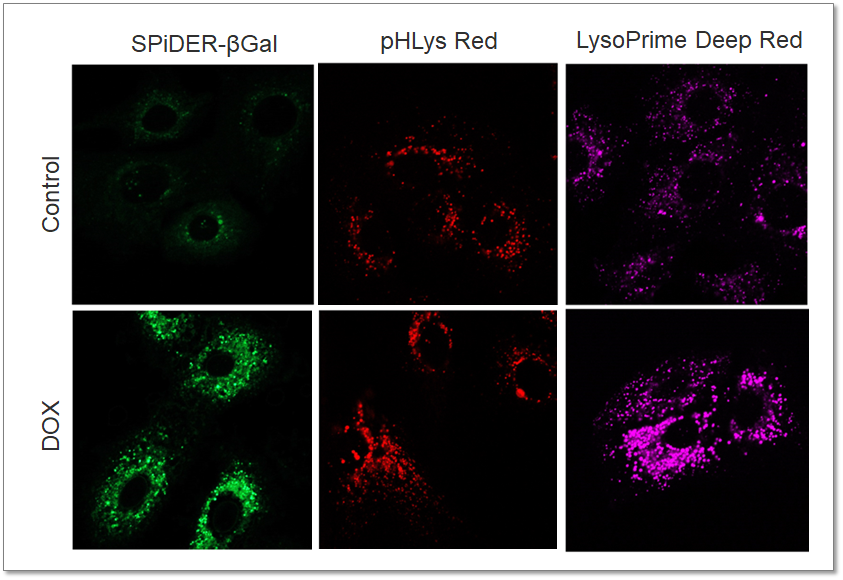
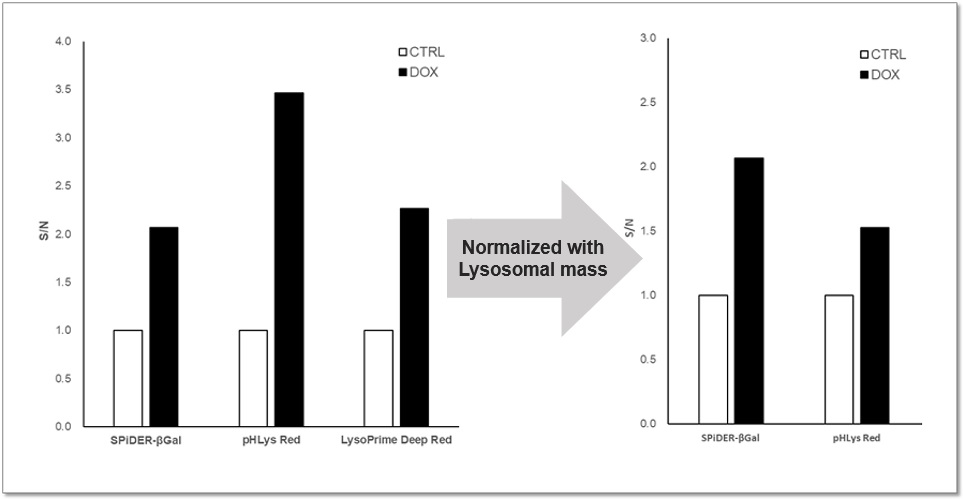
関連技術情報:老化誘導におけるリソソームpHと量の変化 |
|