これからはじめる 細胞内代謝
- 試薬/キット一覧・セミナー/学術動画
- 各疾患における細胞内代謝の変化
がん
・がん研究における標的ごと学術情報
・アミノ酸代謝阻害と抗がん作用
・脂肪酸代謝阻害と抗がん作用
・がん免疫と代謝糖尿病
・高血糖状態によるポリオール代謝の亢進
老化
・老化関連疾患と乳酸、NAD+の関係
MASH
・MASH(非アルコール性脂肪肝炎)
その他
・グルタミン代謝とオートファジー
・参考資料 - 関連の学術情報
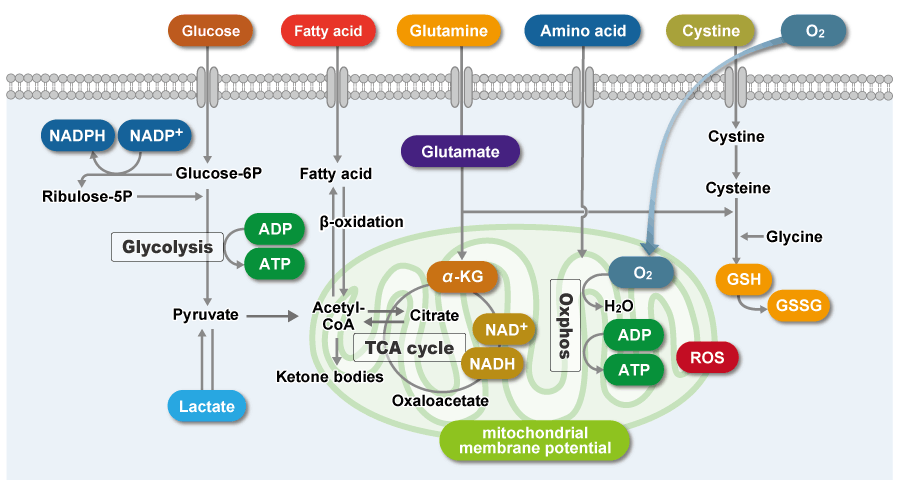
細胞内の代謝システムである、解糖系やミトコンドリアにおけるTCA回路、電子伝達系等の解析は、細胞状態を理解する上で重要です。
これらの代謝システムを理解するため、グルコースや乳酸、NAD(P)/NAD(P)Hといった代謝産物や栄養素の取り込み、ミトコンドリア活性に関わるミトコンドリア膜電位、酸素消費速度(Oxygen comsumption rate:OCR)等が評価されています。
本ページでは、各種疾患と関係が深い代謝指標について論文報告例を元に紹介しています。
セミナー/学術動画
セミナー/学術動画
細胞内代謝測定:試薬の選び方 |
細胞内代謝測定:試薬の使い方 |
ミトコンドリア:試薬の選び方 |
グルコース取込み検出:開発者解説 |
細胞増殖/毒性試験:試薬の選び方 |
|
各代謝測定法の比較や測定意義を セミナー本編はこちら |
細胞内代謝と関連の複数指標を、 セミナー本編はこちら |
ミトコンドリア解析法と関連する セミナー本編はこちら |
検出目的から従来測定法との比較など 開発者の解説動画はこちら |
各種測定法の原理と指標を解説し |
各疾患における細胞内代謝の変化
がんや糖尿病などの疾患モデルの細胞内代謝について近年注目されています。 各疾患における代謝指標の変化について関連文献と併せてご紹介します。
がん細胞は、活発な細胞増殖を維持するため迅速に大量の栄養素を取り込み、代謝することによってタンパク質や核酸の合成、ATPなどのエネルギー産生を行っています。また、細胞にとって不利な環境(低酸素や低栄養)下であっても、がん細胞は代謝系を変化させて生存しています。そのため、近年、がん細胞の代謝系を解明する研究が活発に進められています。
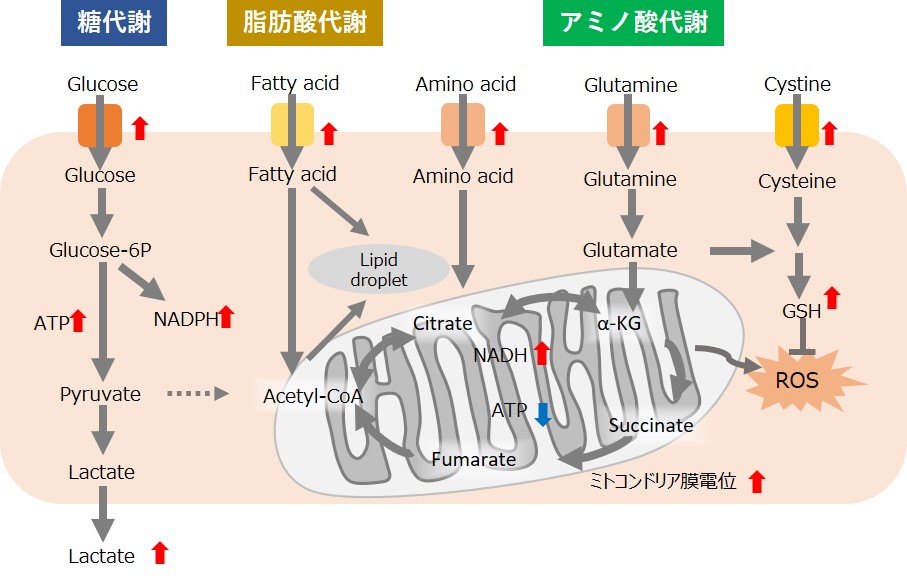
特徴的な代謝として、がん細胞はミトコンドリアの酸化的リン酸化よりも非効率な解糖系を用いてATPを産生します(ワールブルグ効果)。そのため、がん細胞は糖を大量に取り込みます。また解糖系の亢進によって乳酸を大量に産生します。解糖系を用いたATP産生には酸素は必要ないため、低酸素下でもがん細胞は増殖することができます。一方、がん細胞のミトコンドリアは、アミノ酸や脂肪を用いてNADH産生を行います。がん細胞のミトコンドリア内NADHはATP産生以外に主にレドックス制御に利用されている、と考えられています。がん細胞のミトコンドリアは異常な機能を有しており、その結果としてミトコンドリア膜電位の上昇(過分極)および過剰な活性酸素の産生を引き起こします。そのため、多くのグルタチオンを産生してレドックスバランスを維持しています。グルタミンやシステインはグルタチオン産生に必須な栄養素となるため、がん細胞ではこれらアミノ酸を過剰に取り込んでいます。さらに、還元型グルタチオンを維持するためにはNADPHが必要となるため、解糖系から続くペントースリン酸経路やミトコンドリアのNADHを利用して高いNADPH濃度を維持しています。
また、最近の研究では、がん細胞は解糖系が抑制されてもミトコンドリア機能を亢進させることでエネルギー代謝を酸化的リン酸化にシフトさせ、生存に必要なATPを産生することが報告されています。
(注意)上述の内容は、がん細胞の一般的な代謝特性を示すものであり、がん細胞の種類や環境によって異なります。
参考文献
下記文献は、がん細胞の代謝研究に関する総説となります。ご研究をはじめる際の参考文献としてご参照ください。
| キーワード | 文献 |
|---|---|
|
解糖系 |
M. G. Vander Heiden, L. C. Cantley, and C. B. Thompson, “Understanding the Warburg Effect: The Metabolic Requirements of Cell Proliferation”, Science, 2009, 324, 1029. |
|
アミノ酸代謝、ROS |
P. Koppula, Y. Zhang, and B. Gan, “Amino Acid Transporter SLC7A11/xCT at the Crossroads of Regulating Redox Homeostasis and Nutrient Dependency of Cancer”, Cancer Commun., 2018, 38, 12. |
|
アミノ酸代謝 |
E. L. Lieu, T. Nguyen, S. Rhyne, and J. Kim, “Amino Acids in Cancer”, Exp. Mol. Med., 2020, 52, 15 |
|
ミトコンドリア、ROS、NADPH |
F. Ciccarese and V. Ciminale, “Escaping Death: Mitochondrial Redox Homeostasis in Cancer Cells”, Front. Oncol. 2017, 7, 117. |
|
NADH |
A. Chiarugi, C. Dolle, R. Felici, and M. Ziegler, “The NAD Metabolome-A Key Determinant of Cancer Cell Biology”, Nat. Rev. Cancer, 2012, 12, 741. (有料) |
がん研究における標的ごと学術情報
下記のタイトルをクリックで該当項目にジャンプします
グルコース代謝阻害と抗がん作用
|
創薬において解糖系の標的タンパク質として、グルコーストランスポーター(GLUT)が挙げられます。がん細胞はグルコーストランスポーターを介して糖を大量に取り込んでいるため、グルコーストランスポーターを直接的に阻害することによって解糖系を抑制することが可能です。またグルコース飢餓、解糖系を担う酵素群(ヘキソキナーゼ: HK、乳酸脱水素酵素:LDHなど)の活性阻害や解糖系の最終産物である乳酸の細胞外への流出抑制も有効な手段です。
|
各阻害剤による細胞内代謝の変化・参考文献 ※表中の指標にあるリンクをクリックすると測定キット・試薬ページが開きます。
| 細胞 | 薬剤・刺激 | 細胞内代謝の状態 | 文献 |
|---|---|---|---|
|
卵巣がん |
GLUT1阻害剤:BAY-876 |
Cancer, 2019, 11, 33 |
|
|
肺がん |
Glucose consumption ↓、Lactate ↓、ATP ↓ |
Int. J. Oncol., 2016, 48, 399 |
|
|
大腸がん |
Glucose uptake ↓、Lactate ↓、Acetyl-CoA ↓ H3K27Ac ↓ |
Cancer Metab., 2015, 3, 10 |
|
|
卵巣がん |
Am. J. Transl. Res., 2016, 8, 4821 |
||
|
結腸がん |
Glucose uptake ↓、Lactate ↓、ATP ↓、ROS ↑、Oxygen consumption rate(OCR) ↓ |
PLoS One., 2014, 9, e85576 |
|
|
ヒトリンパ腫 |
LDH阻害剤:FX11 |
Proc. Natl. Acad. Sci. USA, 2010, 107(5), 2037 |
|
|
ヒトリンパ腫 |
Glucose uptake ↓、細胞内Lactate ↑、(細胞外Lactate ↓) |
Cancer Res., 2017, 77(21), 5913 |
アミノ酸代謝阻害と抗がん作用
|
レドックス制御に必要なシステインは、他のアミノ酸とは異なり、主にシスチントランスポーターであるxCTによって細胞内に取り込まれています。がん細胞では活性酸素が大量に発生しているため、抗酸化物質であるグルタチオン産生を高めてレドックスバランスを維持しています。そのため、グルタチオン産生に関与する経路を阻害することで細胞内レドックスバランスを変化させ、フェロトーシスなどの細胞死を誘導することが可能です。またグルタチオンは薬剤耐性にも寄与しているため、グルタチオン産生に関与する経路は薬剤開発の主要なターゲットとなっています。特に最近では抗炎症薬として古くから用いられているスルファサラジンやがんの分子標的治療薬であるソラフェニブがxCTを阻害することが明らかとなり、 xCT阻害によるフェロトーシスを介した抗がん作用に注目が集まっています。
|
各阻害剤による細胞内代謝の変化・参考文献 ※表中の指標にあるリンクをクリックすると測定キット・試薬ページが開きます。
| 細胞 | 薬剤・刺激 | 細胞内代謝の状態 | 文献 |
|---|---|---|---|
|
T細胞リンパ腫(KO99L) |
LAT1阻害剤:JPH203 |
ミトコンドリア膜電位 ↓、オートファジー ↑ |
Leukemia, 2015, 29, 1253 |
|
ヒト結腸がん細胞(LS174T) ヒト肺がん細胞(A549) |
Glutamine uptake↓、Leucine uptake↓ |
J. Biol. Chem., 2018, 293(8), 2877 |
|
|
ヒト子宮頸がん細胞(HeLa) |
Tryptophan uptake↓ |
J. Immunol., 2011, 187(4), 1617 |
|
|
ヒト肺がん細胞(A549) |
Glutamine uptake↓、ROS ↑ |
Clin. Cancer Res., 2013, 19(3), 560 |
|
|
ヒト骨肉腫(MG63.3) |
Cancer&Metab., 2020, 8:4 |
||
|
白血病細胞(OCI-AML3) |
Alanine↓、Glutamate ↓、Oxygen consumption rate(OCR)↓ |
Mol. Cancer Ther., 2019, 18(11), 1937 |
|
|
ヒト非小細胞肺がん(H1299) ヒト乳腺がん(MDA-MB231 ) |
ROS ↑、GPx activity↓ |
Cancer Cell, 2015, 27, 257 |
|
|
ヒト卵巣がん(A2780) |
Sci. Rep., 2018, 8(1), 968 |
||
|
マウスメラノーマ(B16-F10) |
PLoS One., 2018, 13(4), e0195151. |
||
|
ヒト繊維肉腫(HT-1080) |
Elife, 2014, 3, e02523 |
||
|
ヒト膵臓腺がん(PANC-1) |
Oncol. Lett., 2018, 15(6), 8735 |
||
|
ヒト肺がん細胞(A549) |
GCL阻害剤:BSO |
Toxicol. Appl. Pharmacol., 1985, 381 |
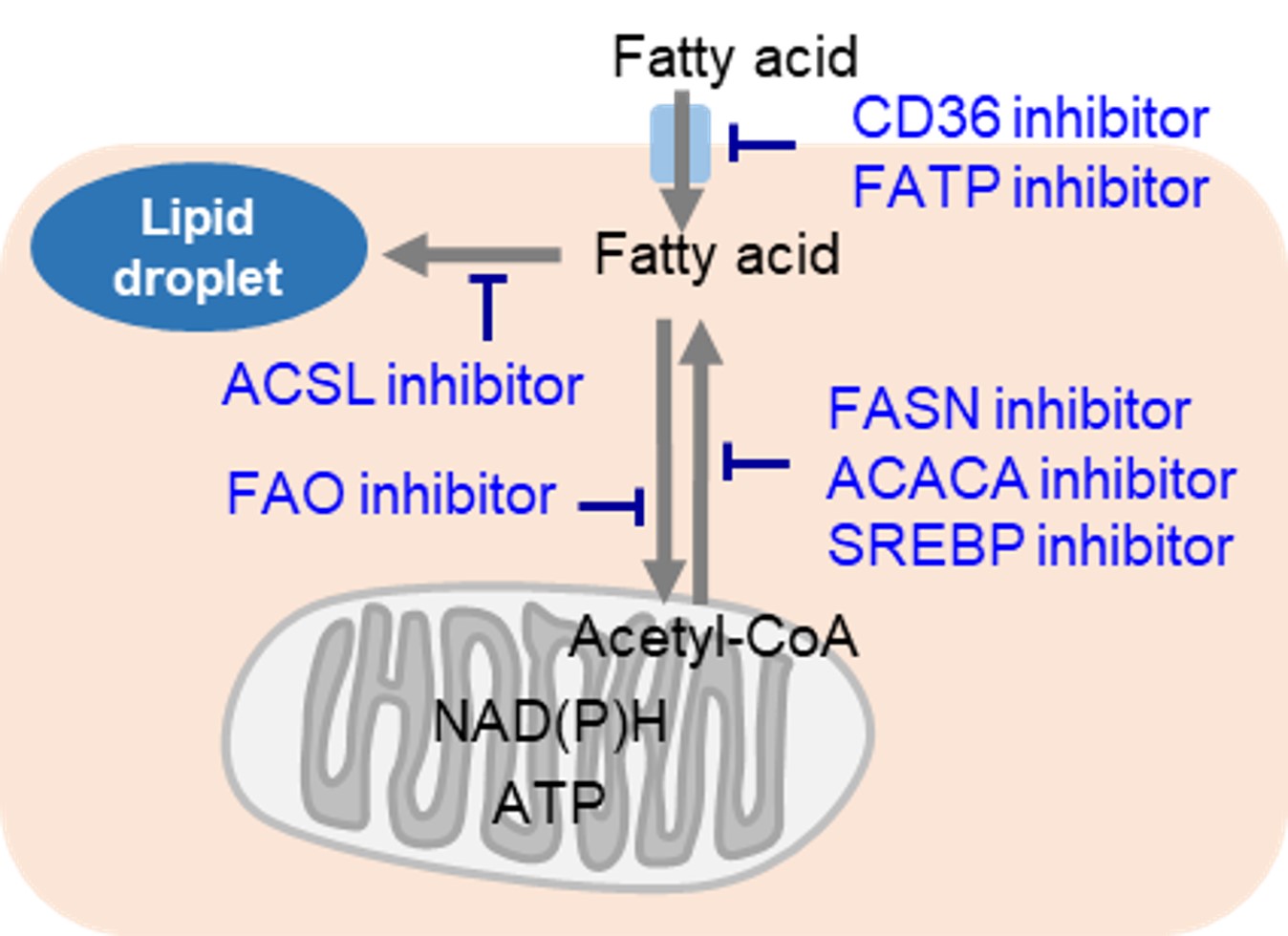
脂肪酸代謝阻害と抗がん作用
|
細胞増殖が活発ながん細胞では、当然ながら多くの脂質を必要とします。そのため、細胞内における脂肪酸合成や細胞外からの脂肪酸取り込みが活発です。そのため、多くのがん細胞では脂肪滴の蓄積が亢進しています。がん細胞に対する治療標的は主に脂肪酸産生に関わる経路であり、多くの阻害剤が開発されています。また一方でがん細胞は、解糖系による非効率なエネルギー産生を補うため、脂肪酸のβ酸化を利用して効率的なエネルギー産生を行っています。そのため、脂肪酸のβ酸化をターゲットとした薬剤開発も行われています。
|
各阻害剤による細胞内代謝の変化・参考文献 ※表中の指標にあるリンクをクリックすると測定キット・試薬ページが開きます。
| 細胞 | 薬剤・刺激 | 細胞内代謝の状態 | 文献 |
|---|---|---|---|
|
CD36高発現乳がん細胞(MCF7、 SUM159) |
CD36阻害剤:SSO |
Cancers, 2019, 11, 2012 |
|
|
ヒト悪性黒色腫(A375、SKMel28) |
Cancer Discov., 2018, 8(8), 1006 |
||
|
ヒト乳がん細胞(BT474、MCF7、T47D) |
Lipid droplet ↓、FA oxidation↓ |
J. Clin. Med., 2020, 9, 87 |
|
|
淡明細胞型腎細胞癌(ccRCC) |
ACACA阻害剤:TOFA FASN阻害剤:C75 |
Mol. Cell Biol., 2017, 37(22), e00265-17 |
|
|
ヒト肺がん細胞(NCI-H1703) |
ACSL阻害剤:Triacsin C |
Int. J. Cancer, 2020, 147, 1680 |
|
|
ヒト膀胱がん細胞(UM-UC-3) |
Lipid droplet ↑、ATP↓、NADPH ↓ |
Clin. Sci., 2019, 133 (15), 1745 |
|
|
ヒト脳腫瘍細胞(SF188) |
Biochim. Biophys. Acta, 2011, 1807(6), 726 |
がん免疫と代謝
|
がん細胞を排除するための免疫システムの中心的な役割を果たしているのがT細胞です。近年、T細胞の分化や活性化などの機能制御にも代謝が関与していることが明らかとなり、がん免疫における代謝研究が活発になっています。がん細胞は大量の栄養素を取り込み増殖活性を維持していますが、活性化T細胞もがん細胞を排除するため大量の栄養素、特にグルコースを必要としています。そのため、活性化T細胞とがん細胞は腫瘍局所で“グルコースの奪い合い”という戦いを繰り広げています。 免疫チェックポイント分子である活性化T細胞表面上のPD-1に対し、がん細胞はPD-L1を発現してT細胞の活性を抑制していることはよく知られていますが、この相互作用がT細胞のグルコース取り込みを抑制していることが近年の研究によって明らかとなっています。がん細胞はこのように免疫系から回避するために免疫細胞の代謝をも制御しており、がん免疫の研究分野ではがん細胞だけでなく、免疫細胞の代謝を理解することが重要となっています。 |
参考文献
| 1) |
Z. Yin, L. Bai, W. Li, T. Zheng, H. Tian, and J. Cui, “Targeting T cell metabolism in the tumor microenvironment: an anti-cancer therapeutic stratety”, J. Exp. Clin. Cancer Res. 2019, 38, 403. |
| 2) | L. Almeida, M. Lochner, L. Berod, and T. Sparwasser, “Metabolic pathways in T cell activation and linear differentiation”, Semin. Immunol. 2016, 28(5), 514. |
| 3) | A. Kumar and K. Chamoto, “Immune metabolism in PD-1 blockage-based cancer immunotherapy”, Int. Immunol., 2020 Jul 5;dxaa046. |
| 4) | D. G. Franchina, F. He, and D. Brenner, “Survival of the fittest: Cancer challenges T cell metabolism”, Cancer Lett., 2018, 412, 216. |
| 5) | N. Patsoukis, K. Bardhan, P. Chatterjee, D. Sari, B. Liu, L. N. Bell, E. D. Karoly, G. J. Freeman, V. Petkova, P. Seth, L. Li, and V. A. Boussiotis, “PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation”, Nat. Commun., 2015, 6, 6692. |
各阻害剤による細胞内代謝の変化・参考文献 ※表中の指標にあるリンクをクリックすると測定キット・試薬ページが開きます。
|
細胞 |
抗原刺激 |
細胞内代謝の状態 |
文献 |
|---|---|---|---|
|
T cell |
活性化 |
J. Immunol., 2008, 180, 4476 |
|
|
CD8(+) T cell |
活性化 |
Glucose uptake ↑、FAO ↓ |
J. Clin. Invest., 2013, 123, 4479 |
|
CD4(+) T cell |
活性化 |
Glucose uptake ↑、Lactate↑、ATP ↑ |
eLife, 2018, 7, e30938 |
|
CD4(+) T cell |
活性化 |
Glutamine uptake ↑、FAO ↓ |
Nat. Commun., 2015, 6, 6692 |
| CD4(+) T cell |
活性化 (PD-1とPD-L1の相互作用) |
Glutamine uptake ↓、FAO ↑ |
高血糖状態によるポリオール代謝の亢進
この結果、酸化ストレスが増加し細胞損傷が促進します 。 |
参考文献
M. Brownlee, “The pathobiology of diabetic complications: a unifying mechanism”, DIABETES, 2005, 54, 1615.
関連製品
| 製品用途 | 製品名 | コード |
|---|---|---|
| NAD/NADH 測定キット | NAD/NADH Assay Kit-WST | N509 |
| NADP/NADPH 測定キット | NADP/NADPH Assay Kit-WST | N510 |
| グルタチオン定量キット | GSSG/GSH Quantification Kit | G257 |
老化関連疾患と乳酸、NAD+の関係
|
近年、NAD+と老化との関係性が注目を集めています。マウスの個体老化モデルでは肝臓等でNAD+量の減少が認められ1)、NAD+合成酵素の阻害は老化様の細胞機能低下を惹起することが報告されています2)。また、NAD+量の減少はミトコンドリア機能低下を招き3)、一方でミトコンドリア機能の低下はNAD+量の減少、ひいては老化様の細胞機能低下を招くことが示唆されています4) 。 老化細胞検出:選択ガイドと老化マップ |
DNA損傷により老化した細胞
老化細胞ではミトコンドリア機能低下に伴い、嫌気的解糖系によるATP産生を主とするため、乳酸産生量が増加しています7)。
老化によるミトコンドリア機能低下の要因の一つとして、DNA損傷が挙げられます。DNAへのダメージが蓄積するとDNA修復機構が活性化し、NAD+消費量が増加します。
NAD+量の減少はミトコンドリア機能維持に重要な因子であるSIRT1活性を下げ、ミトコンドリア機能低下(電子伝達系阻害→ATP産生・NAD+量の低下)を招きます3), 8)。
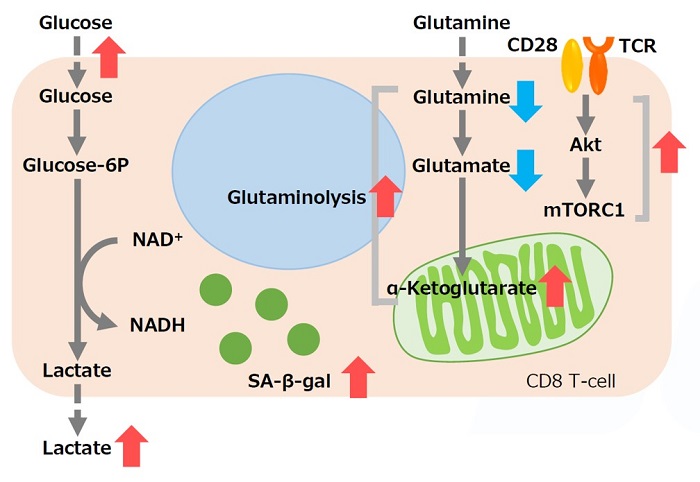
グルタミン代謝と細胞老化
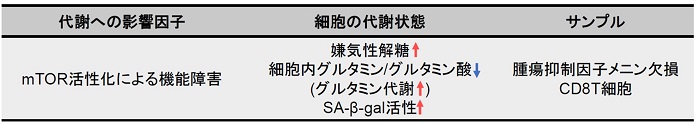
腫瘍抑制メニンは、mTORC1 依存性代謝活性化を標的とすることにより、エフェクター CD8T 細胞機能障害を防止する9)
メニンは、老化や疲労などのT 細胞機能障害の予防に重要な役割を果たす腫瘍抑制因子である。メニンが欠乏すると、mTORC1 が活性化され、解糖系やグルタミン分解を介した酸化的リン酸化が亢進、CD8T 細胞の機能障害を引き起こす。また、グルタミン代謝中間産物である α-Ketoglutarate は、mTORC1の活性化を維持、細胞老化の促進に寄与する (SA-β-gal 活性の亢進) 。グルタミン-α-Ketoglutarate 経路が、CD8T 細胞機能障害の誘導に重要な役割を果たし、メニンがT細胞の老化を阻害する可能性が示唆されている。
参考文献
関連製品
| 製品用途 | 製品名 | コード |
|---|---|---|
| 細胞老化検出キット(蛍光顕微鏡・フローサイトメーター用) | Cellular Senescence Detection Kit - SPiDER-βGal | SG03 |
| 細胞老化検出キット(マイクロプレートリーダー用) | Cellular Senescence Plate Assay Kit - SPiDER-βGal | SG05 |
| JC-1 ミトコンドリア膜電位検出キット | JC-1 MitoMP Detection Kit | MT09 |
| MT-1 ミトコンドリア膜電位検出キット | MT-1 MitoMP Detection Kit | MT13 |
MASH(非アルコール性脂肪肝炎)
非アルコール性肝疾患(NAFLD)は飲酒歴にかかわらず、高齢者に好発する肝臓の病態変化であり、脂肪肝(Steatosis)から非アルコール性脂肪肝炎(MASH)を経て、線維化を伴う肝硬変(Cirrhosis)・肝癌(HCC)へと進行する包括的な疾患概念です1)。近年、細胞老化とそれに伴うミトコンドリア機能異常がNAFLD/MASHの進展に大きく寄与していることが報告され注目を集めております2,3,4,5)。NAFLD/MASHのリスクファクターである肥満状態では、脂質の沈着が増加し活性酸素種(ROS)や炎症性サイトカインの産生が亢進し、細胞老化が惹起されます2)。細胞老化に伴うNAD+量の低下によりミトコンドリア機能は低下3)し、ミトコンドリア機能の低下はさらなるNAD+量の低下を招き老化様の細胞機能変化を増長します4)。一方で肝臓特異的に細胞老化を誘導することで脂質沈着の増加、線維化の促進が認められたこと5)から、NAFLD/MASHの進展過程では細胞老化やミトコンドリア機能異常、それに付随する代謝変化が複雑に平衡して炎症・線維性の病態を形成していることが明らかとなっております。今後この複雑な平衡関係とNAFLD/MASHとの関係をより詳細に解析していくことが新たな治療方法確立への一助となると期待されています。

各NAFLD/MASHモデルにおける報告例 ※表中の指標にあるリンクをクリックすると測定キット・試薬ページが開きます。
| NAFLD/MASHモデル | 細胞機能、代謝変化等 | 文献 |
| 老化、肥満、糖尿病モデルマウス | 肝細胞老化(SA-β-Gal↑、p21↑)⇒ 老化細胞の除去により病態改善 | Nat. Commun., 2016, 8, 15691. |
| 高脂肪食+高コレステロール食処理マウス | 肝臓でのミトコンドリア機能異常(ATP↓、膜電位↓、過酸化水素産生量↑) | Redox Biol., 2018, 15, 86-96 |
| 高脂肪食処理マウス | 肝臓でのミトコンドリア機能異常(ATP↓、NAD↓)、PARP↑ ⇒ PARP発現抑制によりミトコンドリア機能改善及び病態改善 | J. Hepatol., 2017, 66, 132–141 |
| 肝星細胞線維化モデル | α-ketoglutarate↑、type I collagen↑ → α-ketoglutarateの添加で線維化改善 | Biosci. Rep., 2020, 40, BSR20193385 |
| 高脂肪食処理マウス | 肝臓での脂質沈着↑、肝機能↓ → α-ketoglutarateの添加で病態改善 | Liver Res., 2020, 4, 94e10095 |
実験例
・ハイコンテントイメージングによる、薬物誘発性脂質症の肝毒性試験
参考文献
| 1) |
T. Hardy, F. Oakley, Q. M. Anstee and C. P. Day, “Nonalcoholic fatty liver disease: pathogenesis and disease spectrum”, Annu. Rev. Pathol., 2016, 11, 451-496. |
| 2) | M. J. Schafer, et al, “Exercise Prevents Diet-Induced Cellular Senescence in Adipose Tissue”, Diabetes, 2016, 65, 1606-1615. |
| 3) | J. Wu, Z. Jin, H. Zheng and L. Yan, “Sources and implications of NADH/NAD+ redox imbalance in diabetes and its complications”, Diabetes Metab. Syndr. Obes., 2016, 9, 145. |
| 4) | A. Bratic and N. Larsson, “The role of mitochondria in aging”, J Clin Invest. 2013, 123(3), 951. |
| 5) | M. Ogrodnik, et al, “Cellular senescence drives age-dependent hepatic steatosis”, Nat. Commun., 2016, 8, 15691. |
グルタミン代謝とオートファジー
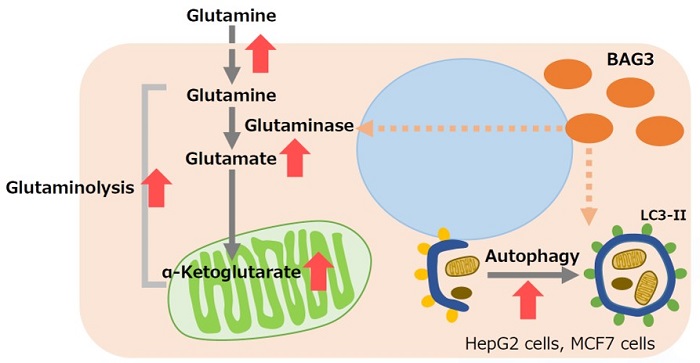
BAG3によるグルタミナーゼの安定化を介したオートファジーとグルタミノリシスの促進
BAG3は、アポトーシスや細胞分化、マクロオートファジー等の様々な細胞機能の制御に関与するタンパク質である。BAG3 が過剰発現した細胞では、グルタミナーゼ (GLS)のスクシニル化が促進されることにより、ユビキチン化とそれに続くプロテアソーム分解が防がれ、GLS タンパク質が安定化する。GLSが安定化することで、グルタミン分解が促進されるため、グルタミン消費が亢進し、細胞内グルタミン酸およびグルタミン代謝中間産物であるα Ketoglutarate が増加する。グルタミン分解の促進により生じる培養液中のアンモニアは、オートファジーの活性化に寄与する。グルタミノリシスが亢進しているがん細胞では、このBAG3 ががん治療の標的になる可能性が示唆されている。
※ BAG3:ヒトの組織全般に普遍的任分布するタンパク質であり、種々のストレスにより誘導される。アポトーシス、細胞分化、マクロオートファジー等の様々な細胞機能の制御に関与する、さらに、がんや加齢に伴う神経変性疾患に関連する、近年注目されているタンパク質。

参考文献
S. Zhao, et al, “BAG3 promotes autophagy and glutaminolysis via stabilizing glutaminase”, Cell Death & Disease, 2019, 284(10).
関連の学術情報
試薬/キット一覧
-
指標 試薬/キット 乳酸 Lactate Assay Kit-WST グルコース Glucose Assay Kit-WST グルコース取込み Glucose Uptake Assay Kit-Blue、Green、Red ATP ATP Assay Kit-Luminescence ADP/ATP ADP/ATP Ratio Assay Kit-Luminescence NAD/NADH NAD/NADH Assay Kit-WST NADP/NADPH NADP/NADPH Assay Kit-WST 脂肪酸取り込み Fatty Acid Uptake Assay Kit アミノ酸取込み Amino Acid Uptake Assay Kit グルタミン Glutamine Assay Kit-WST グルタミン酸 Glutamate Assay Kit-WST α-ケトグルタル酸 α-Ketoglutarate Assay Kit-Fluorometric Oxygen Consumption Rate (OCR) Extracellular OCR Plate Assay Kit 解糖系/酸化的リン酸化 Glycolysis/OXPHOS Assay Kit
-
指標 試薬/キット トータルROS ROS Assay Kit -Highly Sensitive DCFH-DA- ミトコンドリアROS mtSOX Deep Red - Mitochondrial Superoxide Detection グルタチオン GSSG/GSH Quantification Kit シスチン Cystine Uptake Assay Kit ミトコンドリア膜電位 JC-1 MitoMP Detection Kit、MT-1 MitoMP Detection Kit 細胞老化 Cellular Senescence Detection Kit - SPiDER-βGal
Cellular Senescence Plate Assay Kit - SPiDER-βGal過酸化脂質 Liperfluo 脂肪滴 Lipi-Blue、Green、Red、Deep Red
Lipid Droplet Assay Kit - Blue、Deep Redオートファジー DAPGreen、DAPRed、DALGreen
- Autophagy Detection







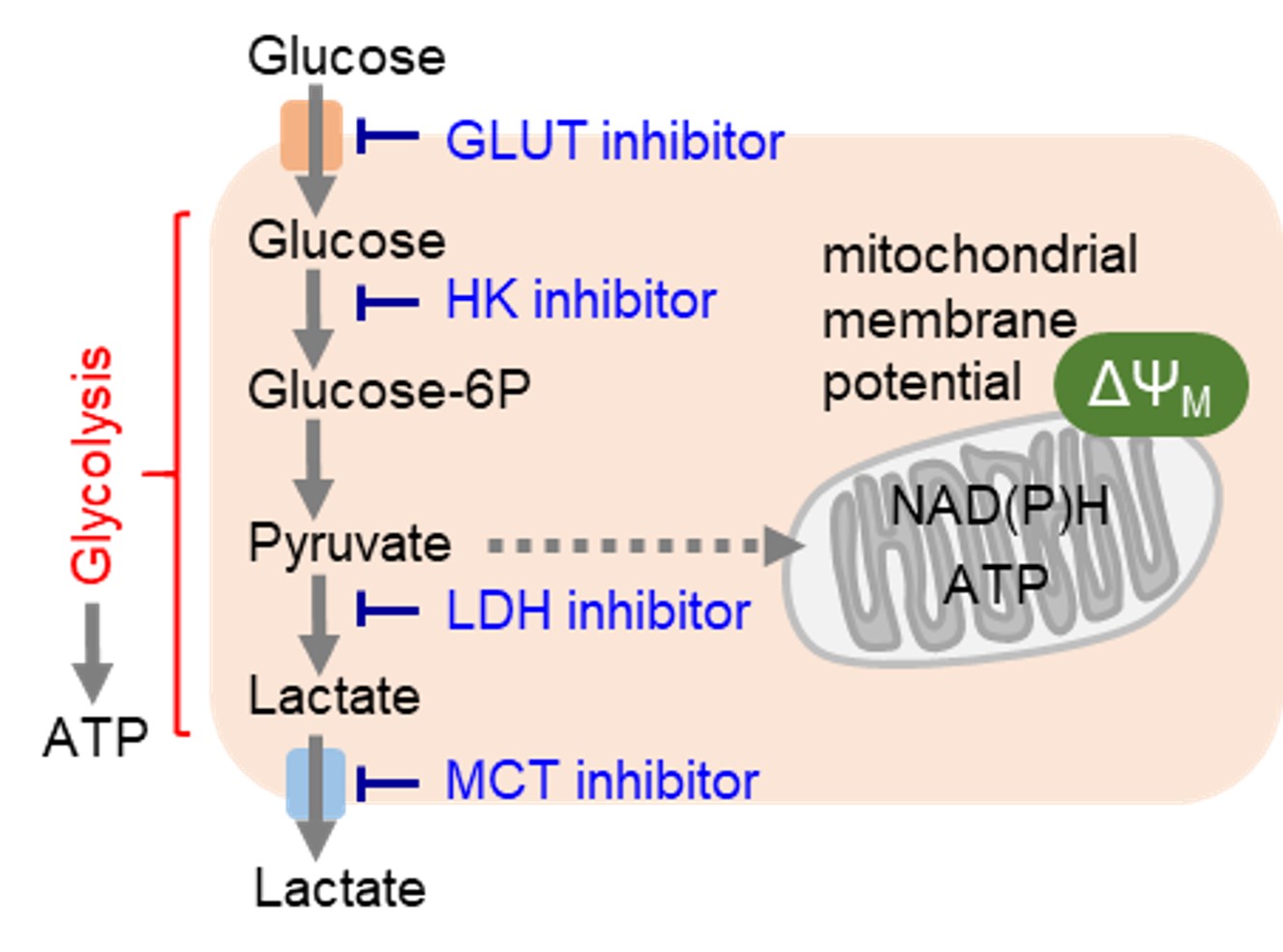 がん細胞は主に解糖系を用いて
がん細胞は主に解糖系を用いて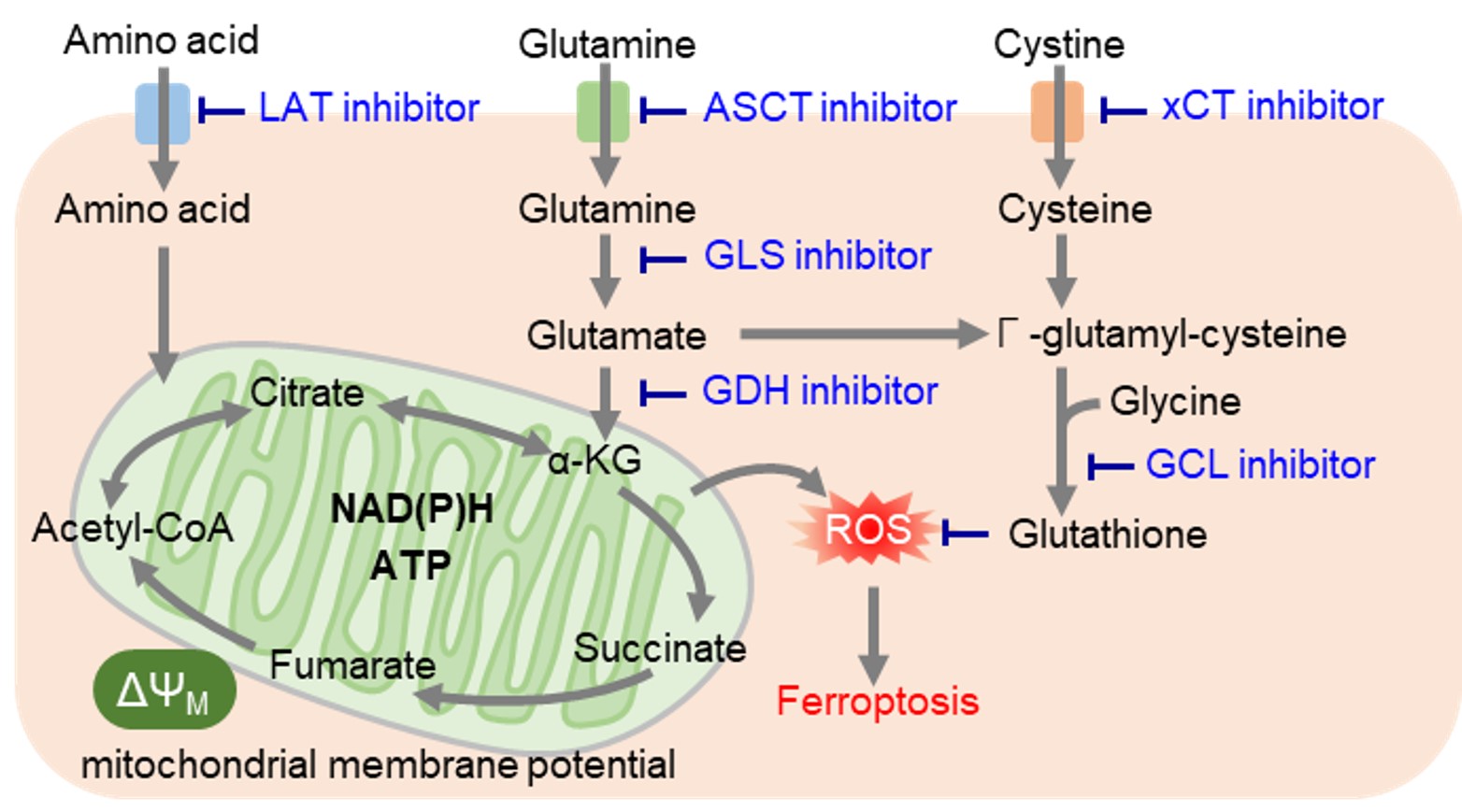 増殖が活発ながん細胞において、アミノ酸はタンパク質や核酸の合成に必須な栄養素です。また、がん細胞では解糖系からのアセチルCoAの供給が低下するため、TCAサイクルの栄養源としてアミノ酸を積極的に利用しています。そのため、がん細胞ではアミノ酸トランスポーターの発現量を増やして、多くのアミノ酸を取り込んでいることが明らかとなっています。特に
増殖が活発ながん細胞において、アミノ酸はタンパク質や核酸の合成に必須な栄養素です。また、がん細胞では解糖系からのアセチルCoAの供給が低下するため、TCAサイクルの栄養源としてアミノ酸を積極的に利用しています。そのため、がん細胞ではアミノ酸トランスポーターの発現量を増やして、多くのアミノ酸を取り込んでいることが明らかとなっています。特に