がん研究とミトコンドリア
がん、細胞死、ミトコンドリアの関係
-
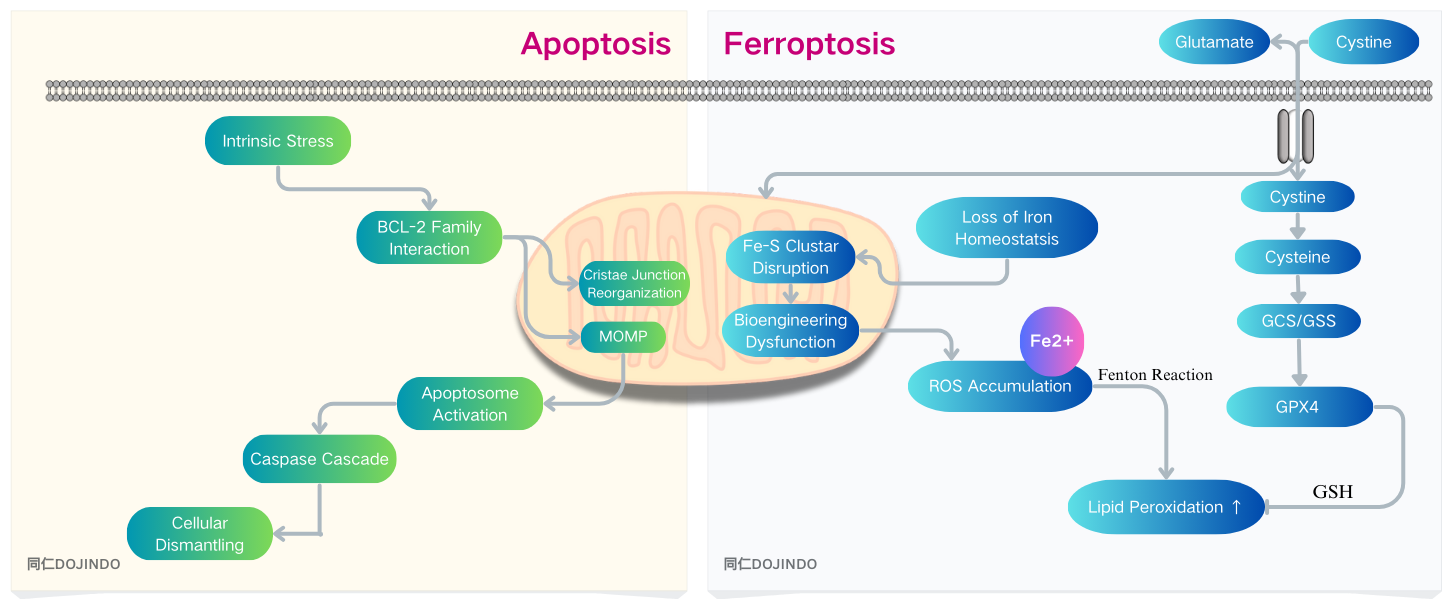
アポトーシスは、腫瘍増殖を抑制し、腫瘍細胞を排除する防御機構
アポトーシスを誘発する主なメカニズムの一つは、ミトコンドリア代謝活性の上昇であり、これはがん細胞における活性酸素(ROS)の上昇につながります。過剰なROSはミトコンドリア機能にダメージを与え、ミトコンドリア膜の脱分極を引き起こし、その結果内在性アポトーシス経路が活性化されます。腫瘍細胞の免疫回避は、腫瘍病態生理学の重要な特徴であり、ミトコンドリアは、免疫応答に関与する複雑なメカニズムの中で、免疫回避の抑制と促進の両方において中心的な役割を果たしています。1)
-
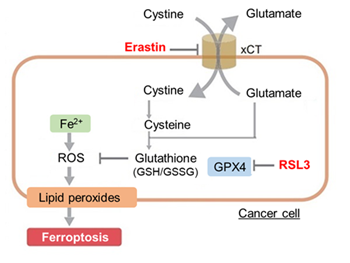
癌治療におけるフェロトーシスの可能性: 多くの研究が、フェロトーシス感受性を利用することで、従来の治療法に抵抗性を示す腫瘍(トリプルネガティブ乳がんや神経膠芽腫など)が標的となりえることを報告しています。2)
フェロトーシスと免疫微小環境: 腫瘍微小環境に存在する好中球はフェロトーシスにより自然死し、放出された過酸化脂質によりT細胞の活性を抑制することで、腫瘍免疫抑制に働く。3)
参考文献
1) Gao, J., Cancer Gene Therapy, 2024, 31, 970-983
2) Yang, F., Cell Metabolism, 2023, 35(1), 84-100
3) Kim, R., Nature, 2022, 612, 338-346
クリックして関連情報をチェック
 |
 |
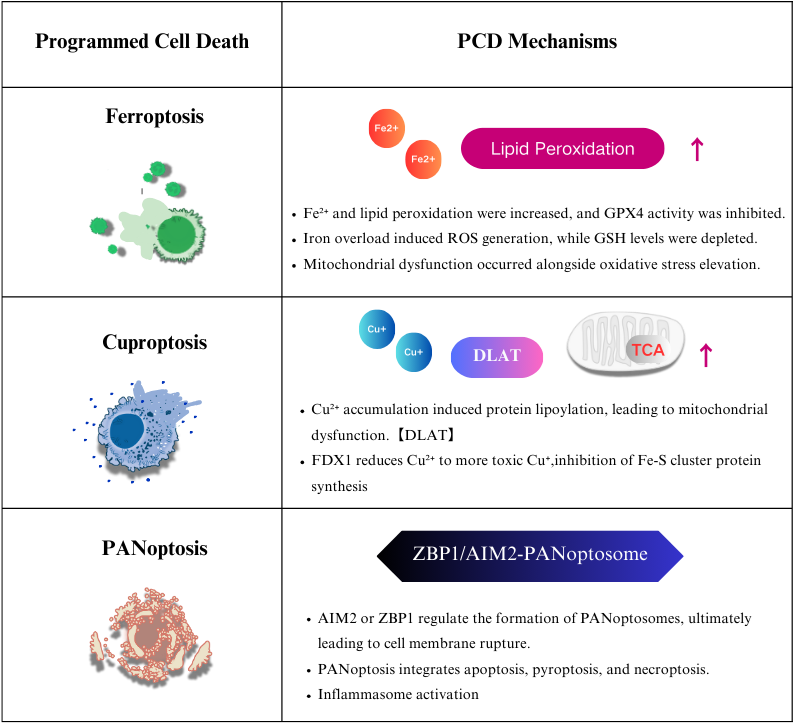
フェロトーシス、カプロトーシス、パノトーシスの相互作用
実験例:薬剤誘導による細胞死の各指標の変化
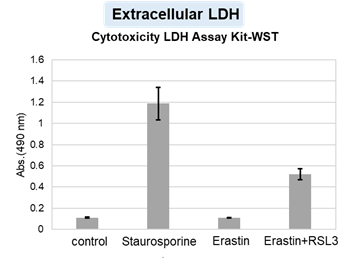
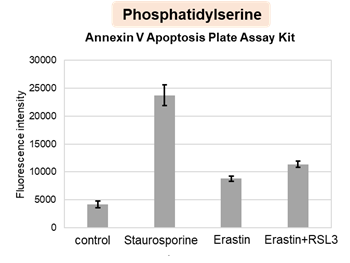
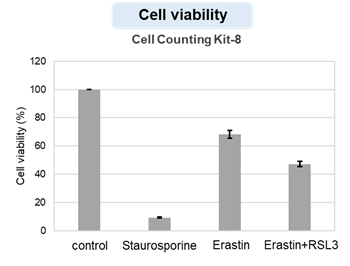
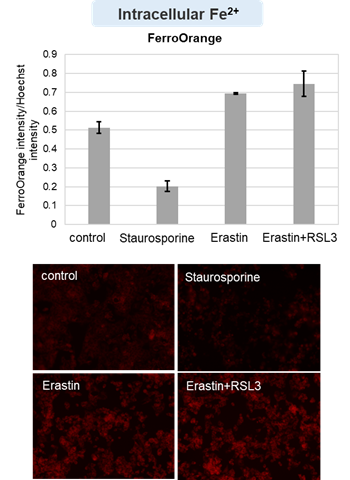
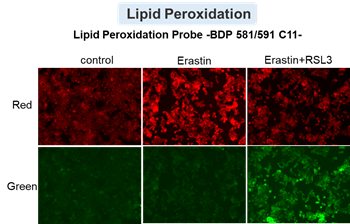
アポトーシス誘導剤であるStaurosporinまたはフェロトーシス誘導剤であるErastin、RSL3で処理したHepG2細胞の細胞外LDH、ホスファチジルセリン、細胞生存率、細胞内Fe2+、脂質過酸化の変化を解析しました。
その結果、Staurosporinで処理したアポトーシス誘導細胞ではホスファチジルセリンの増加、細胞生存率の低下並びに細胞外LDHが増加し細胞死が起きていることが確認できました。一方でフェロトーシス指標である細胞内Fe2+は変化がありませんでした。フェロトーシス誘導剤であるErastinで処理した細胞では細胞内Fe2+の増加と細胞生存率の低下が確認されましたが、細胞外LDHと脂質過酸化(脂質過酸化:赤色蛍光の減少と緑色蛍光の増加)は増加しませんでした。Erastinに加えてRSL3を同時に処理し、より強力にフェロトーシスを誘導した細胞では、フェロトーシスの指標である細胞内Fe2+と脂質過酸化の増加並びに細胞生存率の低下が確認され、死細胞が増加しました。一方で、ホスファチジルセリンはアポトーシス誘導細胞と比較し、フェロトーシス誘導時には増加率が低い結果となりました。これらの結果から、細胞死の指標を組み合わせて評価することで細胞死を見分けられることがわかりました。
<使用製品>
細胞外LDH :Cytotoxicity LDH Assay Kit-WST(製品コード:CK12)
ホスファチジルセリン:Annexin V Apoptosis Plate Assay Kit(製品コード:AD12)
細胞生存率 :Cell Counting Kit-8(製品コード:CK04)
細胞内Fe2+ :FerroOrange(製品コード:F374) *Hoechst 33342の蛍光強度で補正
脂質過酸化 :Lipid Peroxidation Probe -BDP 581/591 C11-(製品コード:L267)
<実験条件>
細胞:HepG2細胞(2×104 cells/well)
薬剤:Staurosporin(5 μmol/l), Erastin(25 µmol/l), Erastin+RSL3(どちらも25 µmol/l)
*無血清培地に希釈して添加
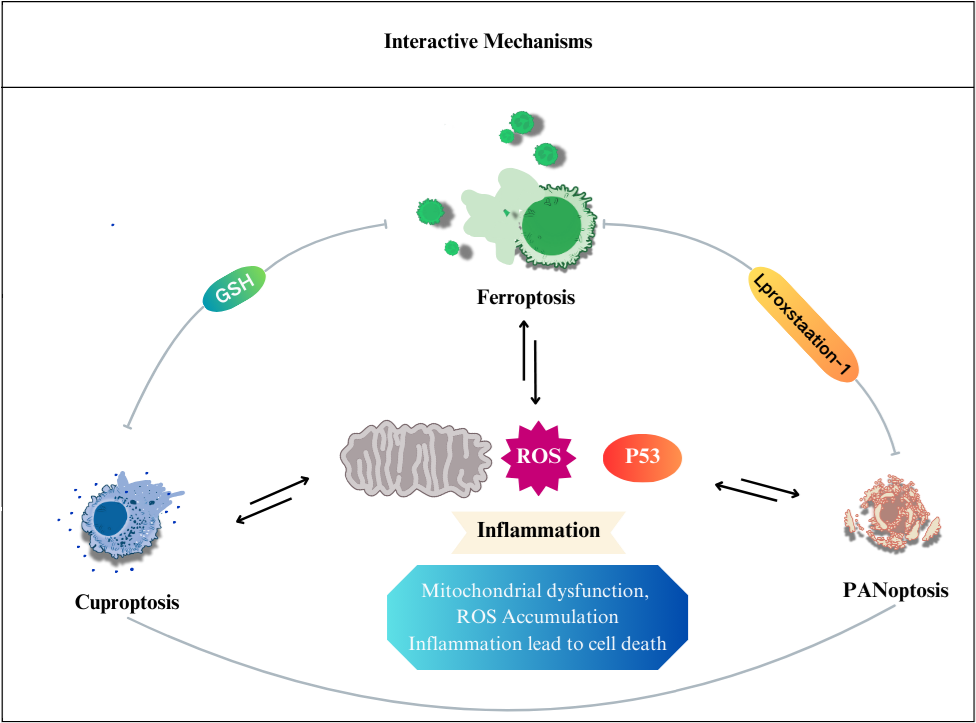
実験例:細胞種における代謝経路依存性の比較
多くのがん細胞は解糖系に依存したエネルギー代謝により ATP を産生しています。一方で、解糖系が抑制されたがん細胞はミトコンドリア機能を亢進させることでエネルギー代謝を酸化的リン酸化にシフトさせ生存していることが近年報告されており、細胞種によって代謝経路の依存性が異なります。
2種類のがん細胞(HeLa細胞とHepG2細胞)における酸化的リン酸化と解糖系へのエネルギー産生の依存度合をLactate生成量とATP量およびOCR値より比較しました。
<Lactate生成量とATP量による評価>
Oligomycin刺激により酸化的リン酸化でのATP合成を阻害、また2-Deoxy-D-glucose(2-DG)により解糖系でのATP合成を阻害した際のATP量とLactate生成量の変化を確認したところ、
HeLa細胞は解糖系に依存し、HepG2細胞は酸化的リン酸化に依存してATP合成している結果が得られました。
*結果の補足説明は右側部分”技術や使用製品に関する補足”をご参照ください。
使用製品:Glycolysis/OXPHOS Assay Kit (製品コード:G270)
<OCR値による評価>
同じ細胞数にてミトコンドリア脱共役剤であるFCCP刺激により、細胞の酸素消費を促進した際のOCRを測定しました。
結果、HepG2細胞はHeLa細胞よりもOCR値が高く酸化的リン酸化への依存度が大きいことが示唆され、ATP量やLactate量を指標に評価した場合と相関する結果が得られました。
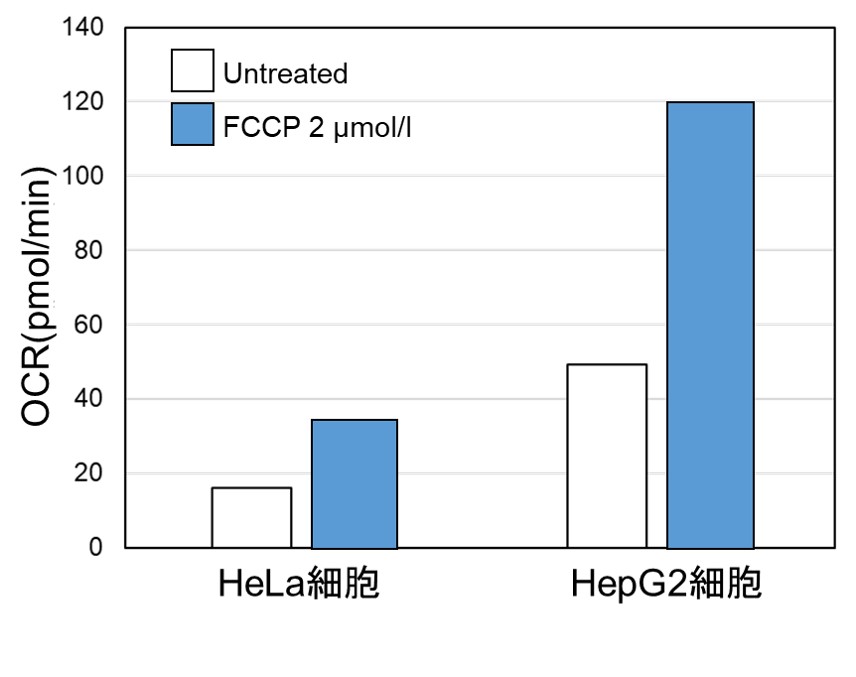
〈実験条件〉
細胞 :HeLa, HepG2
細胞数 :5×104 cells/well
薬剤 :FCCP
薬剤濃度:2 μmol/l
使用製品:Extracellular OCR Plate Assay Kit (製品コード:E297)
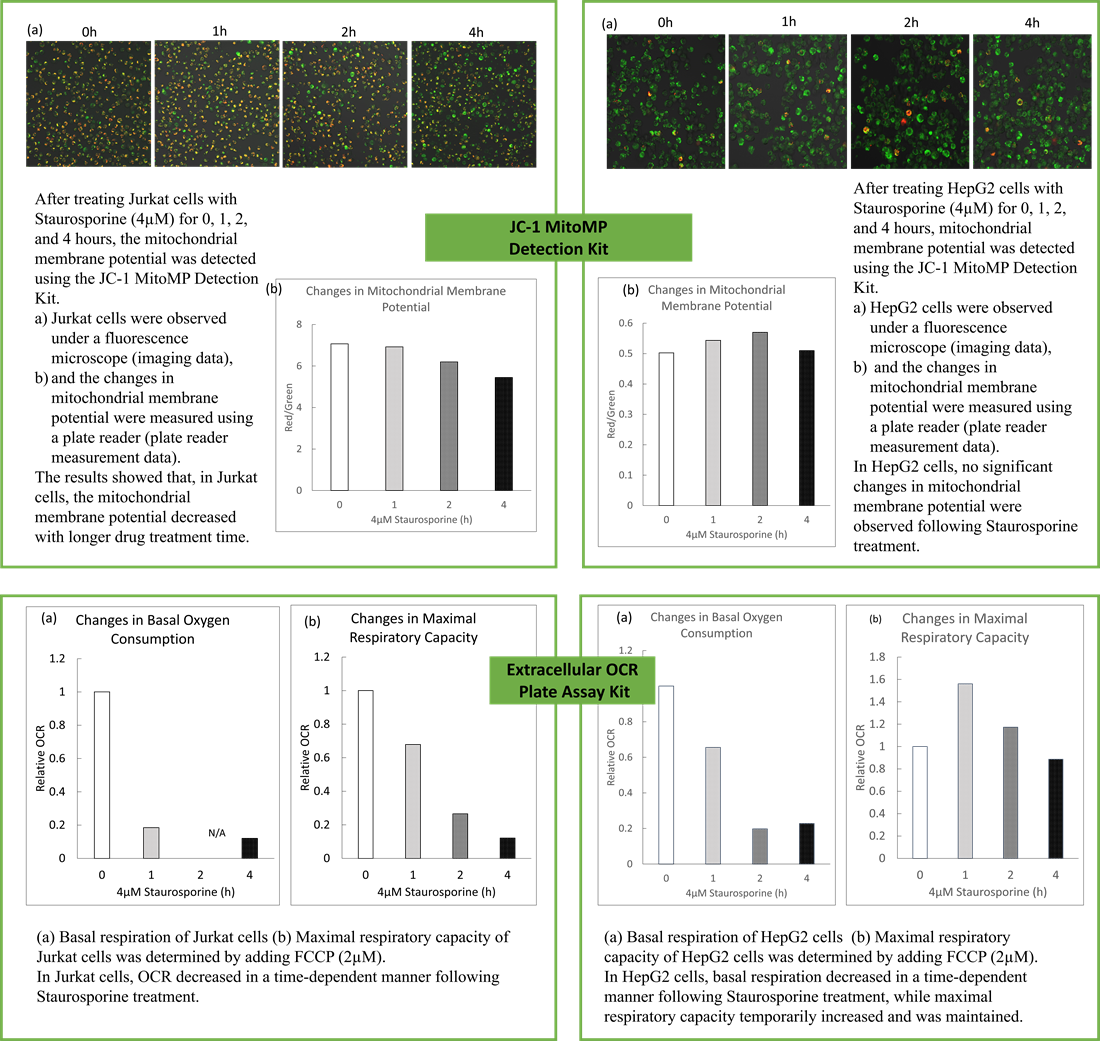
実験例:アポトーシス過程におけるOCRとミトコンドリア膜電位の変化
関連製品:
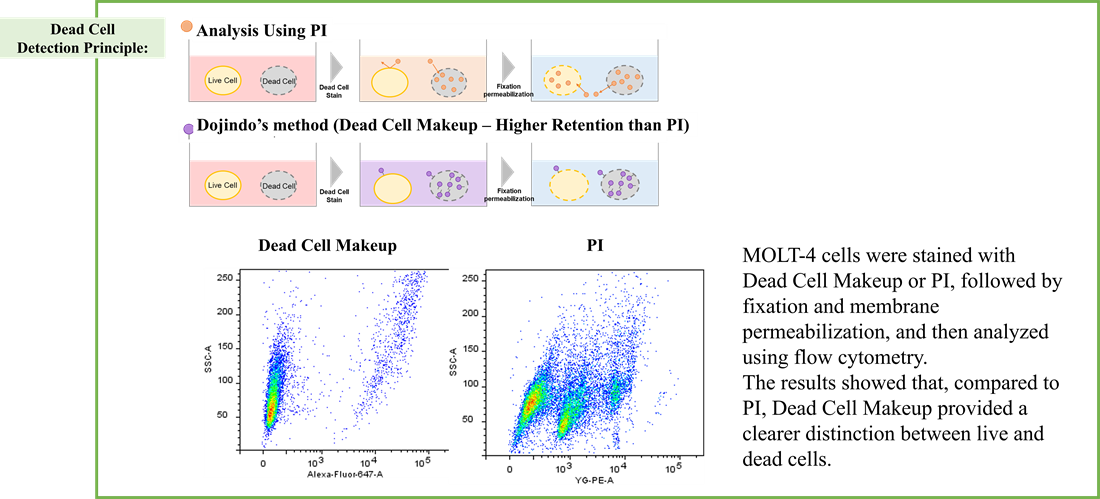
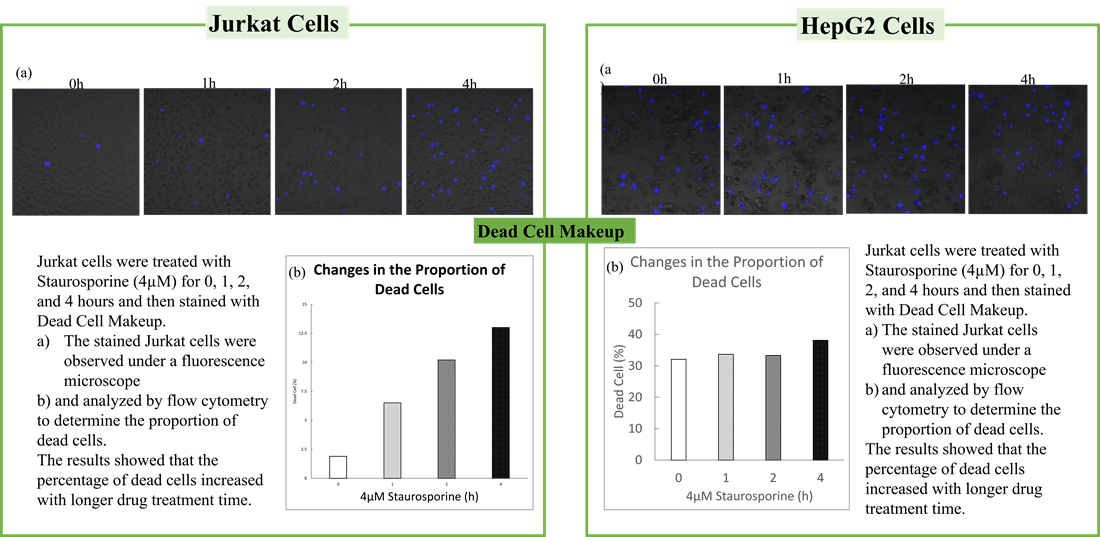
死細胞検出 - C555 Dead Cell Makeup Blue - Higher Retention than PI
ミトコンドリア膜電位検出 - MT09 JC-1 MitoMP Detection Kit
細胞外酸素消費(OCR)測定 - E297 Extracellular OCR Plate Assay Kit
・HepG2細胞とJurkat細胞をStaurosporine(4μM)で処理し、アポトーシスを誘導した。
・OCR測定試薬、ミトコンドリア膜電位検出試薬(JC-1)、死細胞検出試薬を用いて、アポトーシス誘導に伴うOCRとミトコンドリア膜電位の時間依存的変化を解析した。
・結果、Jurkat細胞ではStaurosporineの処理時間依存的に細胞死が認められ、細胞死の増加に伴いミトコンドリア活性(膜電位とOCR)の低下が認められた。一方で、HepG2細胞4μM Staurosporine処理ではいずれの処理時間でも細胞死は認められず、ミトコンドリアの基礎呼吸低下は認められたが最大呼吸活性はStaurosporine短時間処理でむしろ増加した。